
科目: 来源: 题型:选择题
| A. | 甲烷分子中两个氢原子被氯原子取代后,有两种不同结构分子 | |
| B. | 甲醛能使蛋白质变性,可用于食品防腐剂 | |
| C. | 甲醇分子与水分子之间存在氢键,使甲醇的水溶性显著增强 | |
| D. | 甲苯与苯互为同系物,均能使KMnO4酸性溶液褪色 |
查看答案和解析>>
科目: 来源: 题型:选择题
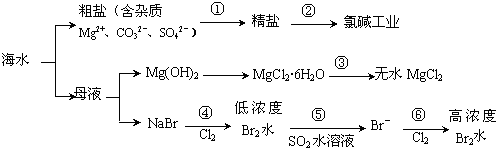
| A. | 过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 | |
| B. | 在过程③中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| C. | 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 | |
| D. | 在过程④、⑥反应中每氧化0.2 mol Br- 需消耗2.24 L Cl2 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 平衡向逆反应方向移动 | B. | B的质量分数增加 | ||
| C. | a>b | D. | A的转化率减小 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
| 实验步骤 | 实验现象 |
| a.取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| b.取少量该溶液加热浓缩,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气可以变成红棕色 |
| c.取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| d.取少量该溶液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于HNO3 |
| e.取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
查看答案和解析>>
科目: 来源: 题型:选择题
 室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )| A. | Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线 | |
| B. | pH=7时,两种酸所用NaOH溶液的体积相等 | |
| C. | V(NaOH)=10.00 mL 时$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COO)}$>1 | |
| D. | V(NaOH)=20.00 mL 时,c(Cl-)<c(CH3COO-) |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 平衡时,X 的转化率为50% | |
| B. | 该握度下平衡常数K=10(10mol•L-1)-1 | |
| C. | 10min内生成物Z 的反应速率0.02mol•L-1•min-1 | |
| D. | 若Y是有色气体,只压缩容器的体积,则体系颜色变浅 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com