
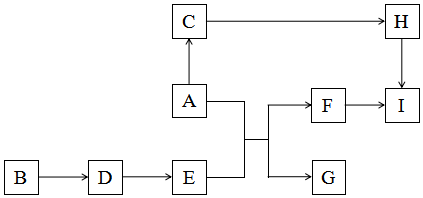
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④① | C. | ③②④① | D. | ①④②③ |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 选择试剂 | 实验操作 |
| A | Al2O3 | SiO2 | NaOH溶液 | 过滤 |
| B | FeCl2 | FeCl3 | Fe粉 | 过滤 |
| C | CO2 | SO2 | 澄清石灰水 | 洗气 |
| D | I2 | NaCl | 酒精 | 萃取、分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将1 mol HCl溶于1 L水中得到的溶液 | |
| B. | 将1 mol SO3溶于1 L水中得到的溶液 | |
| C. | 将1 mol H2SO4溶于水制成的体积1 L的溶液 | |
| D. | 将0.5 mol SO3溶于水制成的体积1 L的溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
 2016年12月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因.
2016年12月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
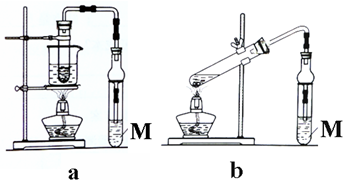
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
 烃A是一种重要的化工原料.己知A在标准状况下的密度为1.16g•L-1,B可发生银镜反应.它们之间的转化关系如图:请回答:
烃A是一种重要的化工原料.己知A在标准状况下的密度为1.16g•L-1,B可发生银镜反应.它们之间的转化关系如图:请回答:查看答案和解析>>
科目: 来源: 题型:选择题
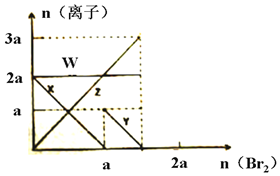 已知氧化性:Br2>Fe3+>I2,向amolFeI2和amolBaCl2的混合溶液中缓慢通入bmolBr2,并不断搅拌,溶液中离子的物质的量随Br2加入的变化如图所示(不考虑盐类水解、水的电离及溶液体积变化).则下列说法不正确的是( )
已知氧化性:Br2>Fe3+>I2,向amolFeI2和amolBaCl2的混合溶液中缓慢通入bmolBr2,并不断搅拌,溶液中离子的物质的量随Br2加入的变化如图所示(不考虑盐类水解、水的电离及溶液体积变化).则下列说法不正确的是( )| A. | 离子的还原性I->Fe2+>Br- | |
| B. | 四条线与溶液中离子的对应关系是:X-Fe2+、Y-I-、Z-Br-、W-Cl- | |
| C. | 当4a=3b时,反应后的离子浓度比:c(Fe2+):c(Fe3+)c:(Br-)=1:2:8 | |
| D. | 当3a≤2b时,发生的离子方程式:2Fe2++4I-+3Br2═2Fe3++2I2+6Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com