
科目: 来源: 题型:实验题
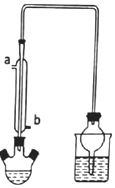 溴乙烷是一种重要的有机化工原料,沸点为38.4℃.实验室可用溴化钠、浓硫酸和乙醉反应制备溴乙烷,实验装置如图(加热和夹持等装置略).
溴乙烷是一种重要的有机化工原料,沸点为38.4℃.实验室可用溴化钠、浓硫酸和乙醉反应制备溴乙烷,实验装置如图(加热和夹持等装置略).查看答案和解析>>
科目: 来源: 题型:解答题
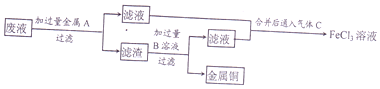
查看答案和解析>>
科目: 来源: 题型:多选题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水中,变石灰水浑浊 | 该溶液中一定含有CO32- |
| C | 向无色溶液中滴加氯水,再加CCl4振荡、静置、溶液分层,下层呈紫红色 | 该溶液中一定含有I- |
| D | 取洁净的铂丝在酒精灯火焰上灼烧至无色,再蘸取少量溶液置于火焰上灼烧,火焰呈黄色,通过蓝色钴玻璃观察,火焰呈紫色 | 该溶液一定含有Na+、K+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
 某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2•3H2O晶体和SOCl2制备少量无水Cu(NO3)2.已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体..
某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2•3H2O晶体和SOCl2制备少量无水Cu(NO3)2.已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体..| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+• | 4.2 | 6.7 |
查看答案和解析>>
科目: 来源: 题型:解答题
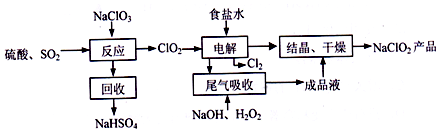
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 采用增大臭氧浓度来改善空气质量 | |
| B. | 利用地热、潮汐等能源替代化石燃料 | |
| C. | 使用可降解塑料减少“白色污染” | |
| D. | 选用不含氮、磷的洗涤剂防止蓝藻污染 |
查看答案和解析>>
科目: 来源: 题型:解答题
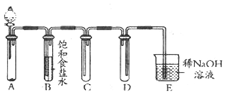 如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置.
如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置.查看答案和解析>>
科目: 来源: 题型:选择题
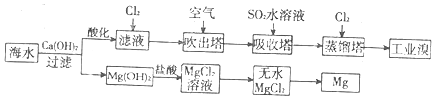
| A. | 若提取1 mol Br2,至少需要标准状况下44.8 L的Cl2 | |
| B. | 工业上常利用电解熔融MgCl2冶炼金属镁 | |
| C. | 富集溴元素过程中,空气吹出法利用了溴易挥发的性质 | |
| D. | 工业溴中含少量Cl2,可用氢氧化钠溶液除去 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  | B. | 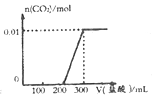 | ||
| C. |  | D. | 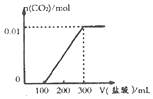 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫酸铝溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 氯化镁溶液中加入氢氧化钠溶液:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 铝片放入过量浓NaOH溶液:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 将铜片放入过量稀HNO3溶液中:3Cu+8HNO3═3Cu2++6NO3-+2NO↑+4H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com