
科目: 来源: 题型:多选题
| A. | 生成了氢氧化铁沉淀 | |
| B. | 溶液中不存在Fe3+ | |
| C. | 加入少量盐酸,则溶液中Fe3+浓度会减小 | |
| D. | 体系中存在着氢氧化铁的沉淀溶解平衡 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加热 | B. | 通入氯化氢气体 | ||
| C. | 加入适量的氢氧化钠溶液 | D. | 加入固体AlCl3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ | B. | H2O2+H2SO4=SO2↑+O2↑+2H2O | ||
| C. | SO2+I2+2H2O=H2SO4+2HI | D. | 2Fe3++2I-=2Fe2++I2 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 氢气与氯气反应生成1mol氯化氢气体,反应吸收248kJ的能量 | |
| B. | 436kJ/mol是指断开1molH2 中的H-H键需要放出436kJ的能量 | |
| C. | 431kJ/mol是指生成2molHCl中的H-Cl键需要放出431kJ的能量 | |
| D. | 氢气与氯气反应生成2mol氯化氢气体,反应放出183kJ的能量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | A、B元素形成的一系列化合物中,其中A元素质量分数的最大值为25% | |
| B. | 四种元素中电负性最大的是B | |
| C. | C所形成的气态氢化物,在其同主族元素的气态氢化物中沸点最低 | |
| D. | 四种元素中第一电离能最小的是D |
查看答案和解析>>
科目: 来源: 题型:实验题
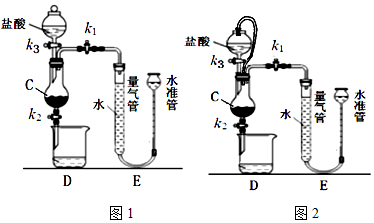
查看答案和解析>>
科目: 来源: 题型:实验题
 某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示.回答下列问题:
某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示.回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题

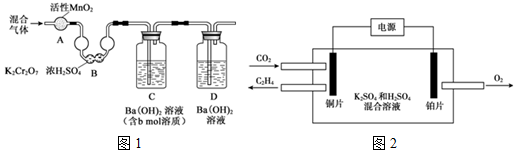
| 温度(℃) CO2 浓度 (mol/L) 时间(min) | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 3×10-3 | 0.9×10-2 | 2.7×10-2 |
| t2 | 1×10-3 | 1.6×10-2 | 3.1×10-2 |
| t3 | 1×10-3 | 1.6×10-2 | 3.1×10-2 |
查看答案和解析>>
科目: 来源: 题型:实验题
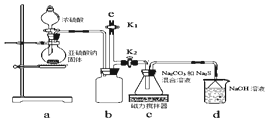 震惊全国的天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏而造成环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理.
震惊全国的天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏而造成环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com