
科目: 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) | |
| B. | X的最高价氧化物对应水化物的酸性比Y的强 | |
| C. | Z的简单气态氢化物的热稳定性比Y的强 | |
| D. | Z分别与X、W形成的化合物的化学键类型相同 |
查看答案和解析>>
科目: 来源: 题型:实验题

| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.5 | 90.0 |
| ② | ? | 0.5 | 2.5 | 36.0 |
| ③ | 碳粉质量的影响 | 0.2 | ? | 90.0 |
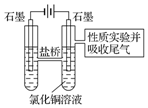
查看答案和解析>>
科目: 来源: 题型:填空题
 (1)下列事实不能说明醋酸是弱酸的是①③
(1)下列事实不能说明醋酸是弱酸的是①③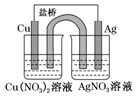 (3)某同学用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)设计成一个原电池,如图所示,下列判断中正确的是d.
(3)某同学用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)设计成一个原电池,如图所示,下列判断中正确的是d.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | m=53 c2=a/b | B. | m=-26.5 2c=a-b | C. | m=-170.5 2c=a-b | D. | m=26.5 c2=$\frac{a}{b}$ |
查看答案和解析>>
科目: 来源: 题型:选择题
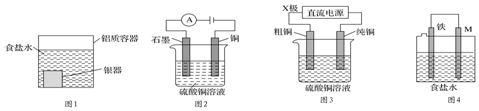
| A. | 用图1装置处理银器表面的黑斑(Ag2S),银器表面发生的反应为Ag2S+2e-═2Ag+S2-,该过程中总反应为2Al+3Ag2S═6Ag+Al2S3 | |
| B. | 用图2装置电解一段时间后,铜电极部分溶解,溶液中铜离子的浓度基本不变 | |
| C. | 图3装置中若直流电源的X极为正极,则该装置可实现粗铜的电解精炼 | |
| D. | 图4装置中若M是铜,则该装置能防止铁被腐蚀 |
查看答案和解析>>
科目: 来源: 题型:多选题
 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )| A. | 从曲线变化可以看出,反应进行到10min至20min时可能采取的措施是使用了催化剂 | |
| B. | 25min时平衡正向移动但达到新平衡后 NH3的体积分数比原平衡大 | |
| C. | 反应开始到第一次平衡时,N2的平均反应速率为0.0625mol•(L•min)-1,H2的转化率为75% | |
| D. | 从曲线变化可以看出,反应进行至25min时,采取的措施是分离出0.1mol的氨气,平衡正向移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 已知CH3OH(l)的燃烧热为238.6 kJ•mol-1,则CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H=-238.6 kJ•mol-1 | |
| B. | 钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀 | |
| C. | 反应H2+Cl2═2HCl(△H<0)的机理包含①Cl2-→2Cl(慢),②H2+Cl-→HCl+H(快),③Cl2+H-→HCl+Cl(快),则反应①的活化能小于反应②的活化能 | |
| D. | 一定条件下反应N2+3H2?2NH3达到平衡时,3v正(H2)=2v逆(NH3) |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com