
科目: 来源: 题型:选择题
| A. | 标准状况下,3.36L氧气与2.4g碳反应,生成CO2分子数为0.2NA | |
| B. | 标准状况下,1.12LCl2发生反应转移的电子数一定为0.1NA | |
| C. | lL0.lmol•L-1氨水中NH3•H2O分子数为0.1NA | |
| D. | 10g46%酒精(C2H5OH)中含氧原子总数大于0.1NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 漂白粉使某些有机颜料褪色 | |
| B. | 一氧化氮气体在空气中变为红棕色 | |
| C. | 用二氧化硫漂白纸浆、毛、丝、草帽辫等 | |
| D. | 向红墨水中投入活性炭,红色褪去 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②③⑤⑦⑧ | B. | ①④⑥⑦ | C. | ①②③⑦⑧ | D. | ②③⑤⑥⑦⑧ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| B. | 钠和冷水反应:Na+2H2O=Na++OH-+H2↑ | |
| C. | 将氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 氢氧化钡溶液与稀硫酸反应:SO42-+Ba2+=BaSO4↓ |
查看答案和解析>>
科目: 来源: 题型:解答题
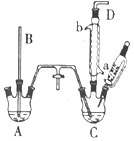 氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下:
氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下: +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$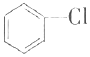 +HCl
+HCl查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
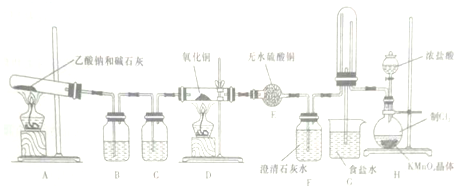
查看答案和解析>>
科目: 来源: 题型:解答题
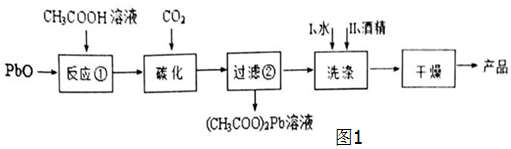
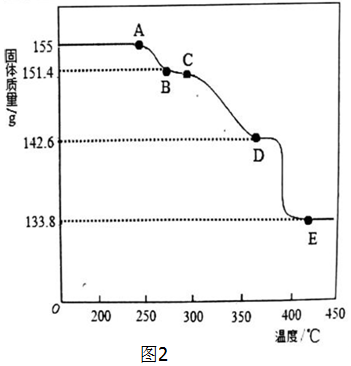
查看答案和解析>>
科目: 来源: 题型:选择题
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | M的同分异构体有3种(不考虑立体异构) | |
| B. | N分子中所有原子共平面 | |
| C. | Q的名称为异丙烷 | |
| D. | M、N、Q均能与Br2反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ②HNO3 | ③NaOH ④KOH | ⑤Na2SO4 ⑥K2SO4 | ⑦SO2 ⑧SO3 | ⑨NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com