
科目: 来源: 题型:实验题
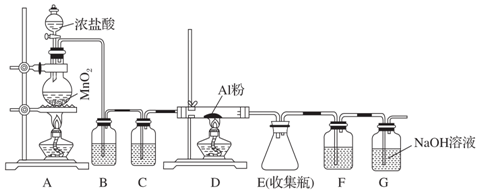
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:实验题
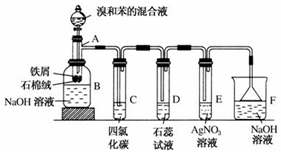
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C+O2$\stackrel{点燃}{→}$CO2 | B. | C(s)+O2(g)$\stackrel{点燃}{→}$CO2(g)+393.5kJ | ||
| C. | C(s)+O2(g)$\stackrel{点燃}{→}$CO2(g) | D. | C(s)+O2(g)=CO2(g)+393.5kJ |
查看答案和解析>>
科目: 来源: 题型:实验题
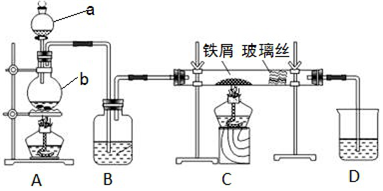
 苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑.
苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑.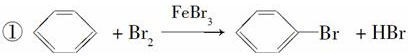 .
.查看答案和解析>>
科目: 来源: 题型:实验题
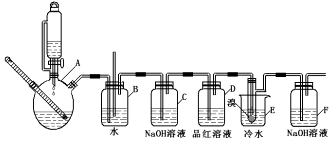
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 | 3.10 |
| 沸点/℃ | 78.5 | 132 | 34.6 | 58.8 |
| 熔点/℃ | -l30 | 9 | -1l6 | -7.2 |
| 水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
查看答案和解析>>
科目: 来源: 题型:实验题
 氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途.完成下列填空:
氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途.完成下列填空:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 形成amolCaCO3 | |
| B. | 形成bmolCaCO3 | |
| C. | 可能得到CaCO3沉淀,但沉淀量小于bmol | |
| D. | 可能最终得到澄清溶液,其中含$\frac{a}{2}$molCa2+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 离子化合物的熔点一定比共价化合物熔点高 | |
| B. | 甲烷的标准燃烧热为890.3KJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| C. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照条件和点燃条件下的△H相同 |
查看答案和解析>>
科目: 来源: 题型:解答题
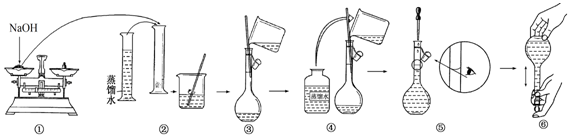
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com