
科目: 来源: 题型:选择题
 取20ml 0.1mol/L氨水溶液(其电离常数为K),用0.10mo/L盐酸滴定.滴定过程中溶液PH变化如图所示.图中a、b、c、d四个点所代表的溶液中,c(OH-)≈K的点是( )
取20ml 0.1mol/L氨水溶液(其电离常数为K),用0.10mo/L盐酸滴定.滴定过程中溶液PH变化如图所示.图中a、b、c、d四个点所代表的溶液中,c(OH-)≈K的点是( )| A. | a点 | B. | b点 | C. | c点 | D. | d点 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH3→NO | B. | Fe3+→Fe2+ | C. | Cl2→NaClO | D. | NO2→HNO3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Zn+2HCl═ZnCl2+H2↑ | B. | 4NH3+5O2═4NO+6H2O | ||
| C. | 2HClO═2HCl+O2↑ | D. | Ca(OH)2+CO2═CaCO3↓+H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 过氧化钠与水反应:2O22-+2H2O═4OH-+O2↑ | |
| B. | 氧化铝与盐酸:O2-+2H+═H2O | |
| C. | NaOH溶液与小苏打溶液反应:HCO3-+OH-═CO32-+H2O | |
| D. | 氯气通入水中:Cl2+H2O?2H++Cl-+ClO- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钠与硫酸铜溶液反应会置换出红色的铜 | |
| B. | 常温下干燥氯气与铁不反应,可以用钢瓶储存液氯 | |
| C. | SO2具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色 | |
| D. | 普通玻璃的组成可用Na2O•CaO•6SiO2表示,是纯净物 |
查看答案和解析>>
科目: 来源: 题型:解答题
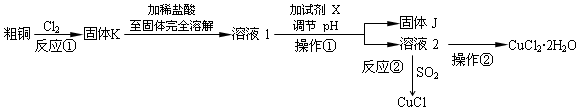
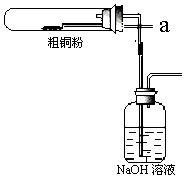
| 平行次数 | 1 | 2 | 3 |
| 0.250g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 过氧化钠不可露置在空气中,要密封保存 | |
| B. | 剩余的金属钠应放回原试剂瓶 | |
| C. | 氢氟酸应密封保存在玻璃瓶中 | |
| D. | 实验室保存FeCl2时常向其中加入铁屑 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com