
科目: 来源: 题型:选择题
| A. | 用石墨棒做电极电解氯化铜溶液,与负极相连的石墨棒上有气泡产生 | |
| B. | 氢氧燃料电池工作时氢气在负极被氧化 | |
| C. | 铅蓄电池充电时,PbSO4仅在负极生成 | |
| D. | 红热的铁丝与冷水接触,表面形成蓝黑色保护层,这种变化属于原电池反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,将pH=2的盐酸和pH=12的氨水等体积混合:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| B. | 0.1mol•L-1 Na2CO3溶液:2c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| C. | 相同温度下,0.6 mol/L氨水溶液与0.3 mol/L氨水溶液中c(OH-)之比是2:1 | |
| D. | 物质的量浓度相等的①NH4HSO4溶液、②NH4HCO3溶液、③NH4Cl溶液中,c(NH4+)的大小关系:①>②>③ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 熵增的化学反应一定自发进行 | |
| B. | 反应物分子碰撞频率越高,化学反应速率越快 | |
| C. | 减小某电解质溶液的浓度,则其溶液中离子浓度不一定减小 | |
| D. | 金属发生电化学腐蚀正极反应一般是:4OH--4e-═O2↑+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作与现象 | 结论 |
| A | 向油脂皂化反应后的溶液中滴入酚酞,溶液变红 | 油脂已经完全皂化 |
| B | 蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,有光亮的银生成 | 蔗糖溶液已经水解完全 |
| C | 向溶液X中滴入NaHCO3溶液,产生无色气体 | X中的溶质一定是酸 |
| D | 向鸡蛋清溶液中滴加醋酸铅溶液,产生白色沉淀,加水沉淀不消失 | 蛋白质发生了变性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
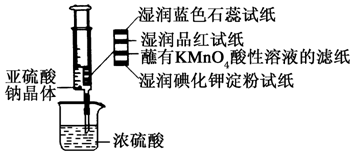 如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )| A. | 湿润的蓝色石蕊试纸先变红后褪色 | |
| B. | 湿润的品红试纸,蘸有KMnO4酸性溶液的滤纸均褪色证明了SO2的漂白性 | |
| C. | 湿润的碘化钾淀粉试纸未变蓝说明SO2氧化性强于I2 | |
| D. | 实验后,可把注射器中的物质推入NaOH溶液,以减少环境污染 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 不溶物一定是铜 | B. | 不溶物一定是铁 | ||
| C. | 不溶物中一定含铜,但不一定含铁 | D. | 滤液中可能含有CuSO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铝元素是地壳中含量最多的元素 | |
| B. | 工业炼铝采用电解熔融的铝土矿的方法 | |
| C. | 冰晶石能使氧化铝熔融温度降低 | |
| D. | 工业上可用电解熔融氯化铝制取金属铝 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫酸与Ba(OH)2溶液反应:H++OH-═H2O | |
| B. | 石灰石溶于盐酸中:CO32-+2H+═H2O+CO2↑ | |
| C. | 氯气与水反应:Cl2+H2O?2H++Cl-+ClO- | |
| D. | 氯化铝溶液与过量氨水反应:3NH3•H2O+Al3+═Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2mol/L | B. | 1.5mol/L | C. | 1mol/L | D. | 0.5mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com