
科目: 来源: 题型:实验题
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 .d中倒置漏斗的作用是:防倒吸,某同学认为如果想验证该反应的类型,可以取反应后烧杯d中溶液,加入稀硝酸酸化,然后加入硝酸银溶液,如果产生了淡黄色沉淀即验证了该反应的类型.试分析该同学的操作是否可行:否(填“是”或“否”),简要说明其原因:进入d烧杯被NaOH溶液吸收的除了HBr外还有Br2蒸汽,加入硝酸银仅能验证d中有溴离子,但是不能说明溴离子来自于HBr还是Br2.
.d中倒置漏斗的作用是:防倒吸,某同学认为如果想验证该反应的类型,可以取反应后烧杯d中溶液,加入稀硝酸酸化,然后加入硝酸银溶液,如果产生了淡黄色沉淀即验证了该反应的类型.试分析该同学的操作是否可行:否(填“是”或“否”),简要说明其原因:进入d烧杯被NaOH溶液吸收的除了HBr外还有Br2蒸汽,加入硝酸银仅能验证d中有溴离子,但是不能说明溴离子来自于HBr还是Br2.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 硅酸盐一般不溶于水,它是水泥、陶瓷、玻璃的主要成分 | |
| B. | SiO2与CO2相似,由一个硅原子和两个氧原子构成一个SiO2分子 | |
| C. | SiO2是酸性氧化物,能与水反应生成硅酸 | |
| D. | 硅元素是构成矿物岩石的主要成分之一,其化合态几乎全部是氧化物和硅酸盐 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验 | 现象 | |
| A | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球.燃烧时,火焰为黄色;燃烧后,生成淡黄色的固体 |
| B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝箔并不滴落,好像有一层膜兜着 |
| C | 在空气中久置的铝条放入NaOH溶液中 | 立刻产生大量无色气泡,铝条逐渐变细,铝条逐渐发热 |
| D | 镁条在CO2中燃烧 | 剧烈燃烧,放出大量的热,产生耀眼白光,生成白色固体和黑色颗粒 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:实验题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂瓶标签上的部分内容.现用该浓硫酸配制500mL浓度为1mol•L-1的稀硫酸.可供选用的仪器有:
如图是某学校实验室从化学试剂商店买回的硫酸试剂瓶标签上的部分内容.现用该浓硫酸配制500mL浓度为1mol•L-1的稀硫酸.可供选用的仪器有:查看答案和解析>>
科目: 来源: 题型:解答题
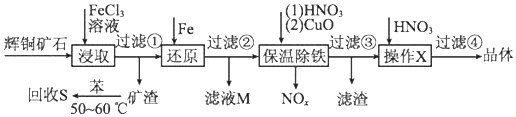
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
查看答案和解析>>
科目: 来源: 题型:实验题
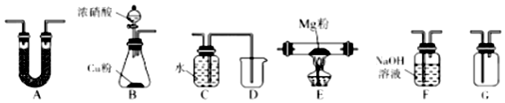
查看答案和解析>>
科目: 来源: 题型:解答题
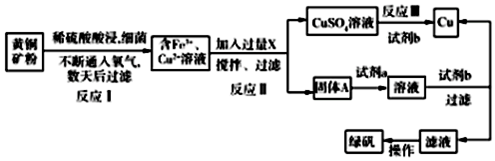
查看答案和解析>>
科目: 来源: 题型:解答题
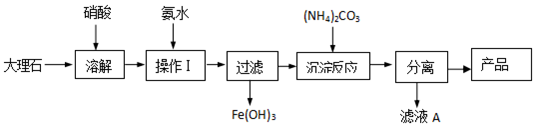
查看答案和解析>>
科目: 来源: 题型:解答题
 乙苯是一种用途广泛的有机原料,可制备多种化工产品.
乙苯是一种用途广泛的有机原料,可制备多种化工产品. +Cl2(g)$\stackrel{催化剂}{?}$
+Cl2(g)$\stackrel{催化剂}{?}$ -CH(g)+HCl(g)△H>0,T℃时,向一恒压密闭容器中充入等物质的量的乙苯气体和氯气发生上述反应(已排除其他反应干扰),测得乙苯物质的量分数随时间变化如表所示:
-CH(g)+HCl(g)△H>0,T℃时,向一恒压密闭容器中充入等物质的量的乙苯气体和氯气发生上述反应(已排除其他反应干扰),测得乙苯物质的量分数随时间变化如表所示:| 时间/(min) | 0 | 2 | 5 | 6 | 9 | 10 |
| χ(乙苯) | 0.5 | 0.25 | 0.1 | 0.1 | 0.05 | 0.05 |
 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$ =CH2(g)+H2(g)△H=+124kJ/mol
=CH2(g)+H2(g)△H=+124kJ/mol查看答案和解析>>
科目: 来源: 题型:选择题
| A. | FeO | B. | Fe2O3 | C. | CuO | D. | Cu2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com