
科目: 来源: 题型:选择题
| A. | v(D)=0.4mol/(L•s) | B. | v(C)=30mol/(L•min) | C. | v(A)=0.15mol/(L•s) | D. | v(B)=0.9mol/(L•s) |
查看答案和解析>>
科目: 来源: 题型:解答题
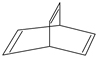 有机物的结构可用键线式简化表示,如CH3-CH═CH-CH3可表示为
有机物的结构可用键线式简化表示,如CH3-CH═CH-CH3可表示为 有一种有机物X的键线式如图所示.
有一种有机物X的键线式如图所示. .
.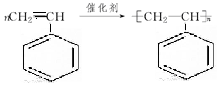 .
.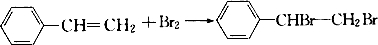 .
.查看答案和解析>>
科目: 来源: 题型:解答题
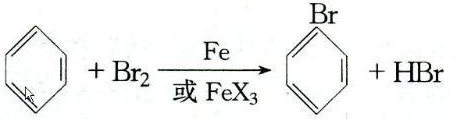 .
.查看答案和解析>>
科目: 来源: 题型:实验题
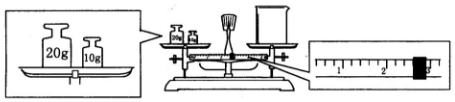
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应物能量总和大于生成物能量总和 | |
| B. | 反应中生成1mol水蒸气放出285.8 kJ的热量 | |
| C. | 2H2O(1)=2H2(g)+O2(g)△H=+571.6 kJ.mol-1 | |
| D. | 当反应中有2 mol H-H键断裂,该反应放出571.6 kJ的热量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-142.9 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O(l)△H=+571.6 kJ•mol-1 | |
| C. | 2H2+O2═2H2O△H=-571.6 kJ•mol-1 | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:实验题
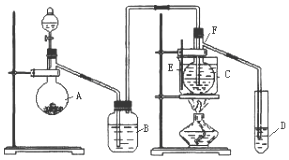
查看答案和解析>>
科目: 来源: 题型:实验题
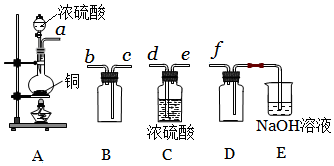
查看答案和解析>>
科目: 来源: 题型:实验题
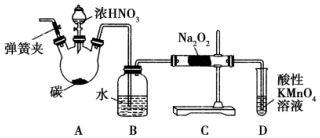 亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水为原料制备亚硝酸钠的装置如图所示.
亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水为原料制备亚硝酸钠的装置如图所示.查看答案和解析>>
科目: 来源: 题型:解答题
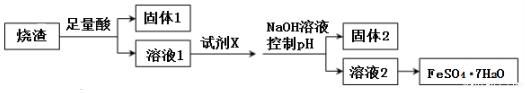
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com