
科目: 来源: 题型:选择题
| A. | 钠燃烧,可用砂子灭火,不能用二氧化碳灭火器来灭火 | |
| B. | 眼睛里不慎溅进了稀药液,应立即用水冲洗,并且用手使劲揉眼睛 | |
| C. | 少量浓硫酸沾到皮肤上,立即用氢氧化钠溶液冲洗 | |
| D. | 熄灭酒精灯可直接用嘴吹 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 分类标准 | 酸性氧化物 | 非电解质 | |
| 属于该类的物质 | ⑦ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 200 mL 1 mol•L-1 KCl溶液 | B. | 50 mL 2 mol•L-1CaCl2溶液 | ||
| C. | 150 mL 2 mol•L-1 NaCl溶液 | D. | 50 mL 1 mol•L-1AlCl3溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电池的电解液为碱性溶液,正极为2NiO(OH)、负极为Cd | |
| B. | 放电时,每通过2 mol电子,负极质量减轻112 g | |
| C. | 放电时,电子从正极流向电源的负极 | |
| D. | 充电时,Cd极板应与外电源的正极相接 |
查看答案和解析>>
科目: 来源: 题型:实验题

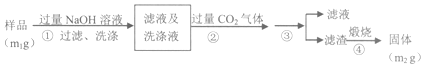
查看答案和解析>>
科目: 来源: 题型:实验题
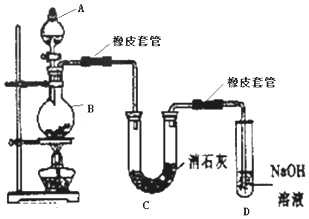
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
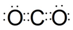 ;该化合物熔沸点低于CS2的原因是两者都为分子晶体,且结构相似,CS2式量大于CO2,CS2范德华力大,故CS2熔沸点高于CO2.
;该化合物熔沸点低于CS2的原因是两者都为分子晶体,且结构相似,CS2式量大于CO2,CS2范德华力大,故CS2熔沸点高于CO2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com