
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 10g H2O和10g NH3 | |
| B. | 0.1mol CO和标准状况下2.24L Cl2 | |
| C. | 22g CO2和标准状况下11.2 L N2 | |
| D. | 标准状况下11.2 L O2和11.2 L NH3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 酸性强弱:H2SiO4<H2CO3<H3PO4 | B. | 原子半径大小:Na>S>O | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 还原性强弱:F->Cl->I- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 质量为32g | B. | 含氧原子数为NA | ||
| C. | 含氧分子数为NA | D. | 在标准状况下,体积约为22.4L |
查看答案和解析>>
科目: 来源: 题型:解答题
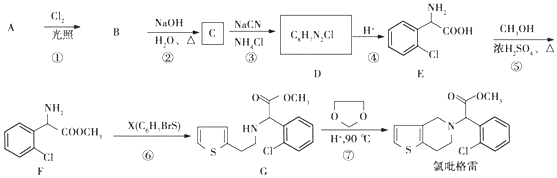
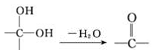 ;②
;②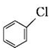 中氯原子较难水解;③RCHO$→_{NH_{4}Cl}^{NaCN}$
中氯原子较难水解;③RCHO$→_{NH_{4}Cl}^{NaCN}$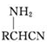
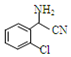 ;C分子中最多有14个原子共平面.
;C分子中最多有14个原子共平面.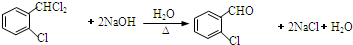 .
. ,需要经历的反应类型有②①③④③(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物
,需要经历的反应类型有②①③④③(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物 的最后一步反应HOCH2CH2OH+HCHO$\stackrel{酸}{→}$
的最后一步反应HOCH2CH2OH+HCHO$\stackrel{酸}{→}$ .
.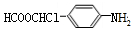 .
.查看答案和解析>>
科目: 来源: 题型:实验题
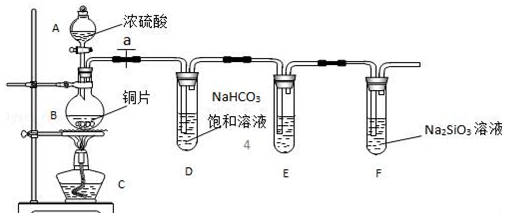
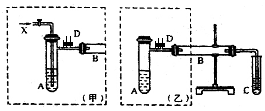 实验室可利用乙二醇、铜或铜的化合物制备乙二醛,右图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出).试回答:
实验室可利用乙二醇、铜或铜的化合物制备乙二醛,右图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出).试回答:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
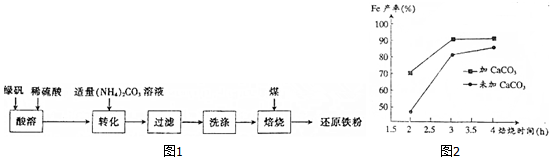
查看答案和解析>>
科目: 来源: 题型:实验题
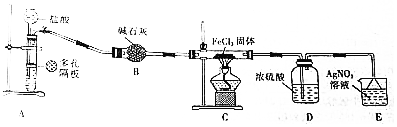
查看答案和解析>>
科目: 来源: 题型:实验题
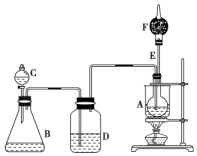 已知CH3CH2OH+NaBr+H2SO4CH3CH2Br+NaHSO4+H2O,如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.
已知CH3CH2OH+NaBr+H2SO4CH3CH2Br+NaHSO4+H2O,如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com