
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入少量水,产生H2速率减小,H2体积不变 | |
| B. | 加入NH4HSO4固体,产生H2速率不变,H2体积不变 | |
| C. | 加入CH3COONa固体,产生H2速率减小,H2体积减小 | |
| D. | 滴加少量CuSO4溶液,产生H2速率变大,H2体积不变 |
查看答案和解析>>
科目: 来源: 题型:解答题
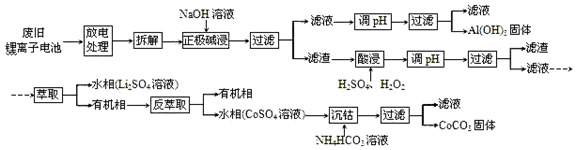
查看答案和解析>>
科目: 来源: 题型:实验题
 乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为:
乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为: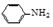 +CH3COOH?
+CH3COOH?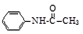 +H2O
+H2O| 名称 | 式量 | 性状 | 密度/g/cm3 | 沸点/℃ | 溶解度 | |
| 苯 胺 | 93 | 无色油状液体,具有还原性 | 1.00 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚等 |
| 乙 酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
| 乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水 | 易溶于乙醇、乙醚 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原气体中肯定有SO2,可能有HCl | B. | 原气体中肯定没有H2S、HBr和CO2 | ||
| C. | 原气体中肯定有SO2和 HCl | D. | 原气体中肯定没有CO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 g H2和8 g O2 | |
| B. | 常温常压下,28 g CO和6.02×1022个CO分子 | |
| C. | 0.1 mol HCl和2.24 L He | |
| D. | 150℃、1.01×105 Pa时,18 L H2O和18 L CO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使用清洁能源是防止酸雨发生的重要措施之一 | |
| B. | 推广“低碳经济”,减少温室气体的排放 | |
| C. | CO2、CH4、N2等均是造成温室效应的气体 | |
| D. | 利用晶体硅制作的太阳能电池可将太阳能直接转化为电能 |
查看答案和解析>>
科目: 来源: 题型:选择题
 在有机物分子中碳原子所连的4个原子或原子团均不相同时,该碳原子叫手性碳原子,含有手性碳原子的有机物具有光学活性,下边有机物含有一个手性碳原子(*C表示手性碳原子),具有光学活性.若要消除其光学活性,可选用下列哪些化学反应( )
在有机物分子中碳原子所连的4个原子或原子团均不相同时,该碳原子叫手性碳原子,含有手性碳原子的有机物具有光学活性,下边有机物含有一个手性碳原子(*C表示手性碳原子),具有光学活性.若要消除其光学活性,可选用下列哪些化学反应( )| A. | 只有①②③ | B. | 只有④⑤⑥ | C. | 只有①②④⑤⑥ | D. | 以上都可以 |
查看答案和解析>>
科目: 来源: 题型:解答题
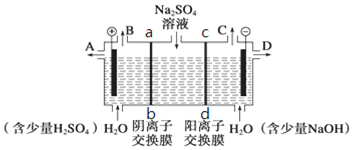
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com