
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题


 .检验该离子常用KSCN溶液.丙的外围电子排布式为3d104s1,在元素周期表中的位置为第四周期ⅠB族.
.检验该离子常用KSCN溶液.丙的外围电子排布式为3d104s1,在元素周期表中的位置为第四周期ⅠB族.查看答案和解析>>
科目: 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目: 来源: 题型:解答题
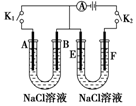 如图所示,A、F为石墨电极,B、E为铁片电极.按要求回答下列问题.
如图所示,A、F为石墨电极,B、E为铁片电极.按要求回答下列问题.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3v逆(B)=v正(C) | B. | 容器内压强不再改变 | ||
| C. | 混合气体密度保持不变 | D. | c(B):c(C):c(N)=1:3:6 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 升高温度 | B. | 分离出CO(NH2)2 | C. | 缩小容器体积 | D. | 使用催化剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
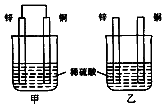
| A. | 两烧杯中铜片表面均无气泡产生 | |
| B. | 两烧杯中溶液的pH均增大 | |
| C. | 甲中电子通过导线由锌片流向铜片,再回到锌片 | |
| D. | 乙中产生气泡的速度比甲快 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向含少量Br2的CCl4中加NaOH溶液,充分振荡,上下两层均为无色 | |
| B. | 向pH试纸上滴加氯水,先变红后变白 | |
| C. | 将红热的铜丝伸入到盛有氯气的集气瓶中,产生蓝绿色的烟 | |
| D. | 往氯水中加入NaHCO3固体,有气体产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com