
科目: 来源: 题型:选择题
| A. | 恒温条件下向水中加入少量Na2SO4固体 | |
| B. | 将水加热煮沸 | |
| C. | 恒温条件下向水中通入SO2气体 | |
| D. | 恒温条件下向水中通入氨气 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 相同温度下,颗粒大小相同的锌粒分别与pH值相同的硫酸和盐酸反应 | |
| B. | A+B$\stackrel{500℃}{→}$C;D+E$\stackrel{100℃}{→}$F | |
| C. | 相同温度下,与同浓度盐酸反应的锌粒和铁粉 | |
| D. | G+H→W+Q(Q>0),其他条件相同时分别在200℃和100℃时反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(OH-)=1×10-7mol/L | B. | c(H+)=1×10-7mol/L | ||
| C. | c(OH-)=c(H+) | D. | pH=7 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 将稀硫酸改用浓硫酸 | B. | 向稀硫酸中加入少量硫酸铜溶液 | ||
| C. | 向稀硫酸中加入硫酸钠固体 | D. | 给装置中发生反应的部分加热 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 豆科作物的根瘤菌对空气中氮的固定 | |
| B. | 将NO2气体冷却后颜色会变浅 | |
| C. | 熟石膏转化为生石膏 | |
| D. | 工业制液态氧 |
查看答案和解析>>
科目: 来源: 题型:解答题
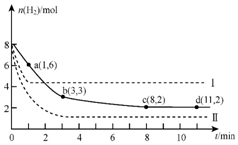 固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的热化学方程式是:CO2+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的热化学方程式是:CO2+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电解质溶液的浓度越大,其导电性一定越强 | |
| B. | 熔融态能导电的物质一定是离子化合物 | |
| C. | 强极性键的共价化合物不一定都是强电解质 | |
| D. | 多元酸、多元碱的导电性一定比一元酸、一元碱的导电性强 |
查看答案和解析>>
科目: 来源: 题型:解答题
 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com