
科目: 来源: 题型:实验题
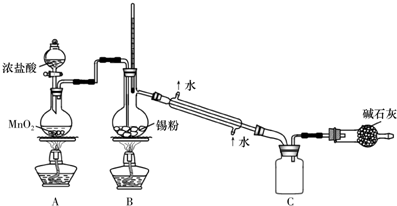
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题
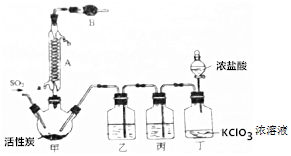
查看答案和解析>>
科目: 来源: 题型:实验题
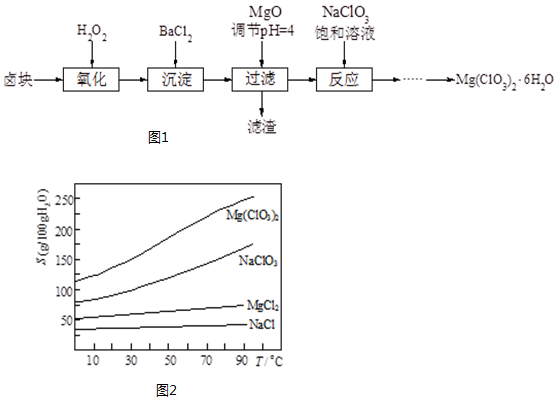
查看答案和解析>>
科目: 来源: 题型:多选题
 “盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg (OH)2下列关于该电池的说法错误的是( )
“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg (OH)2下列关于该电池的说法错误的是( )| A. | Mg电极的电极反应式:Mg-2e-=Mg2+ | |
| B. | 这种电池的工作原理可以认为是镁的吸氧腐蚀 | |
| C. | 活性炭电极上发生氧化反应 | |
| D. | 电池工作时实现了化学能向电能的转化 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2,4,5,6 | B. | 3,4,5,6 | C. | 2,3,4,5 | D. | 4,5,6,7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 号序 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
| ① | KNO3 | KOH | 加入FeCl3溶液,并过滤 |
| ② | FeSO4 | CuSO4 | 加入足量铁粉后过滤 |
| ③ | O2 | CO2 | 依次通过盛有浓硫酸和NaOH溶液的洗气瓶 |
| ④ | CaO | CaCO3 | 加入稀盐酸,再蒸发 |
| A. | ①④ | B. | ② | C. | ②④ | D. | ②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com