
科目: 来源: 题型:实验题
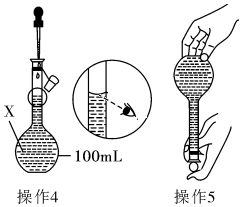 某同学欲配制100mL 0.10mol•L-1的CuSO4溶液.以下操作1~5是其配制的过程及示意图:
某同学欲配制100mL 0.10mol•L-1的CuSO4溶液.以下操作1~5是其配制的过程及示意图:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH4没有同分异构体 | B. | CH3Cl没有同分异构体 | ||
| C. | CH2Cl2没有同分异构体 | D. | CCl4没有同分异构体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- | |
| B. | 滴加石蕊呈红色的溶液可能大量存在K+、NH4+、Cl-、S2- | |
| C. | 与Al反应能放出H2的溶液中可能大量存在:Fe2+、K+、NO3-、SO42- | |
| D. | 漂白粉的水溶液可能大量存在Fe2+、Cl-、Ca2+、Na+ |
查看答案和解析>>
科目: 来源: 题型:解答题
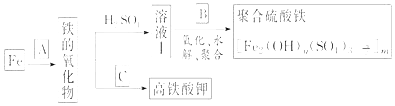
查看答案和解析>>
科目: 来源: 题型:实验题
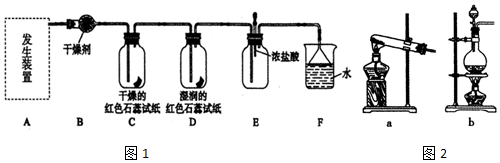
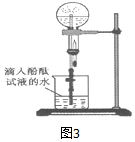
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | MgO、Al2O3熔点高,均可用作耐高温材料 | |
| B. | NH4HCO3受热易分解,可用作氮肥 | |
| C. | Fe2(SO4)3易溶于水,可用作净水剂 | |
| D. | SO2具有氧化性,可用于漂白纸浆 |
查看答案和解析>>
科目: 来源: 题型:实验题
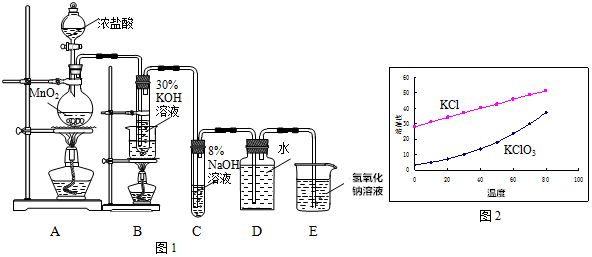
查看答案和解析>>
科目: 来源: 题型:解答题
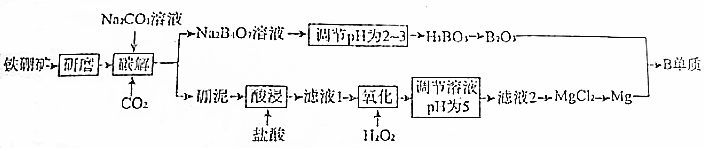
查看答案和解析>>
科目: 来源: 题型:解答题
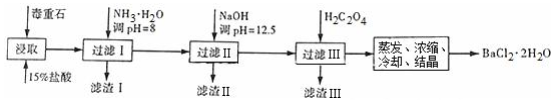
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
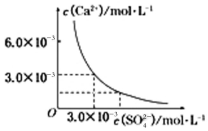
查看答案和解析>>
科目: 来源: 题型:实验题
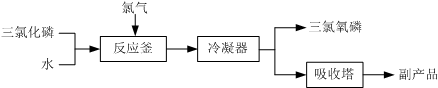
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com