
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
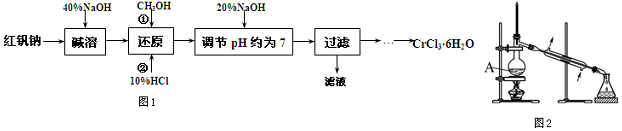
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 电解硫酸或酸式硫酸盐溶液,阳极反应为2SO42--2e-═S2O82- | |
| B. | S2O82-具有强氧化性,H2S2O8是二元强酸 | |
| C. | 减压蒸馏的目的是为了减少H2O2分解,蒸馏得到的另一组分可循环利用 | |
| D. | 由溶液A转化为溶液B发生了氧化还原反应 |
查看答案和解析>>
科目: 来源: 题型:填空题
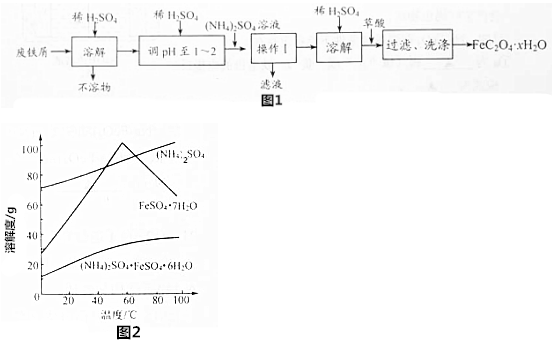
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0 | |
| B. | 已知2CO(g)+O2(g)=2CO2(g)△H=-566 kJ•mol-1,则CO的燃烧热△H=-283 kJ | |
| C. | 已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,则稀H2SO4溶液和稀Ba(OH)2溶液反应的反应热△H═2×(-57.3)kJ•mol-1 | |
| D. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,热化学方程式为:N2(g)+3H2(g)$?_{500℃/30Mpa}^{催化剂}$ 2NH3(g)△H=-38.6 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
 置换反应的通式可用如图表示,单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
置换反应的通式可用如图表示,单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:查看答案和解析>>
科目: 来源: 题型:推断题

查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3支 | B. | 2支 | C. | 1支 | D. | 0支 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 热的纯碱溶液去油污效果好 | |
| B. | 新制的氯水在光照条件下颜色变浅 | |
| C. | 收集氯气用排饱和食盐水的方法 | |
| D. | 500℃左右比室温更有利于合成氨的反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com