
科目: 来源: 题型:实验题
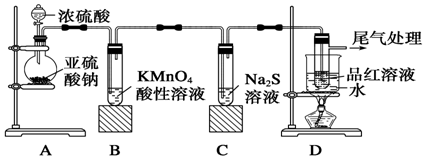
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在该温度下平衡常数K=1 | |
| B. | 平衡时通入CO气体,则再次达平衡时,H2O的转化率增大.而CO的转化率减小 | |
| C. | 平衡时CO的体积分数为25% | |
| D. | 平衡常数与反应温度无关 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NO2、NO、O2的物质的量之比是2:1:1 | |
| B. | 单位时间内生成1mol O2的同时生成2mol NO2 | |
| C. | 混合气体的颜色不再改变的状态 | |
| D. | 混合气体的平均相对分子质量不再改变的状态 |
查看答案和解析>>
科目: 来源: 题型:解答题
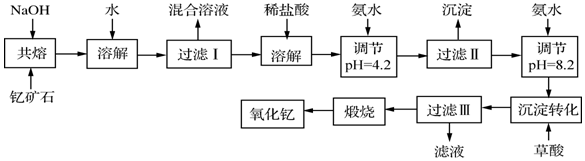
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
查看答案和解析>>
科目: 来源: 题型:实验题
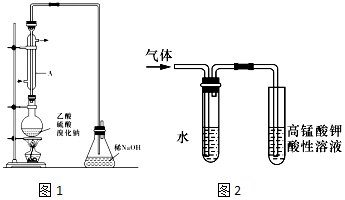
查看答案和解析>>
科目: 来源: 题型:实验题
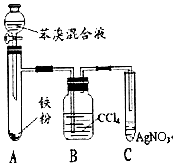 已知:溴苯不溶于水,密度1.5g/cm3,熔点-30.7℃,沸点156.2℃;苯的沸点为80.1℃.如图是制取溴苯并探究其反应类型的装置.
已知:溴苯不溶于水,密度1.5g/cm3,熔点-30.7℃,沸点156.2℃;苯的沸点为80.1℃.如图是制取溴苯并探究其反应类型的装置. .
.查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 溶液X中一定含有Na+、Cl-和SiO32- | |
| B. | 溶液X中一定不含Ca2+、Br- | |
| C. | 为确定溶液X中是否含有SO42-,可取溶液2,加入BaCl2溶液 | |
| D. | 在溶液X中依次滴入盐酸、双氧水和硫氰化钾溶液后,溶液将变为红色 |
查看答案和解析>>
科目: 来源: 题型:实验题
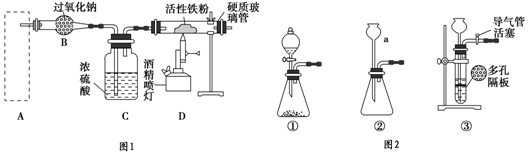
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na+、NO3- | B. | S2-、AlO2- | C. | Al3+、Fe3+ | D. | MnO4-、NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com