
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
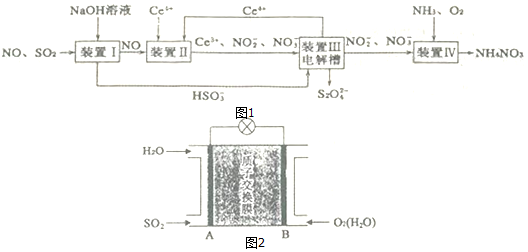
 为有效控制雾霾,各地积极采取措施改善大气质量,有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量,有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碱性:KOH>NaOH | B. | 金属性:Na>Al | C. | 稳定性:HF>CH4 | D. | 酸性:HClO<HClO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 次氯酸钠溶液可用作环境的杀菌消毒 | |
| B. | 硅胶可用作商品包装袋的干燥剂 | |
| C. | 爆竹燃放后,硫燃烧生成SO3 | |
| D. | 施肥时,草木灰不能与胺态氮肥混合使用 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 实验A | 实验B | |
| 操作 | 在注射器中加入过量镁片(擦去表面氧化膜),吸入15mL饱和NaHCO3溶液. | 在注射器中加入过量镁片(擦去表面氧化膜),吸入15mL蒸馏水. |
| 现象 | 有气体产生,20min后注射器内壁和底部产生大量白色沉淀 | 缓慢产生气体 |

查看答案和解析>>
科目: 来源: 题型:解答题
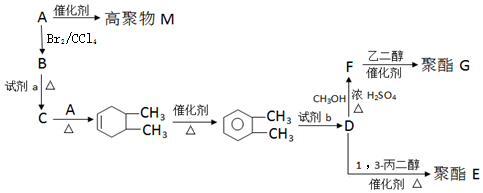
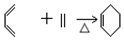
 ②B→C
②B→C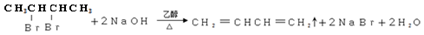
 .
. 以CH3CHO为初始原料,选择必要试剂,经过三步反应合成化合物C,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
以CH3CHO为初始原料,选择必要试剂,经过三步反应合成化合物C,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 证明“84”消毒液的氧化能力随溶液pH的减小而增强 | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 |
| B | 证明反应速率会随反应物浓度的增大而加快 | 用3 mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL 1mol•L-1CuSO4溶液,迅速产生较多气泡 |
| C | 检验Na2SO3晶体是否已氧化变质 | 将Na2SO3样品溶于稀硝酸后,滴加BaCl2溶液,观察是否有沉淀生成 |
| D | 证明同温度下氯化银的溶解度大于硫化银的溶解度 | 向2 mL0.1 mol•L-1硝酸银溶液中加入1mL0.1mol•L-1 NaC1溶液,出现白色沉淀,再加入几滴0.1 mol•L-1的Na2S溶液,有黑色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子式为C5H12的有机物有三种,它们互为同系物 | |
| B. | 淀粉和纤维素的化学式相同,化学性质相似 | |
| C. | 乙酸乙酯在过量氢氧化钠溶液中加热,生成乙酸和乙醇 | |
| D. | 溶解度:甘油>1-丁醇>甲酸甲酯 |
查看答案和解析>>
科目: 来源: 题型:选择题
| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 | |
| 腐蚀快慢 | 较快 | 慢 | 较快 | |||||
| 主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2- | ||||
| A. | 随pH的升高,碳钢腐蚀速率逐渐加快 | |
| B. | pH<4,发生析氢腐蚀 | |
| C. | pH为14,其负极反应为2H2O+Fe_3e-═FeO2-+4H+ | |
| D. | pH为7时,负极反应为Fe_3e-═Fe3+,生成的Fe3+被空气中的氧气氧化为Fe2O3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 空气中:CO2、NO、N2、NH3 | |
| B. | 明矾溶液中:H+、Mg2+、Na+、Cl- | |
| C. | 过量铁与稀硝酸反应后的溶液中:H+、Cl-、I-、Na+ | |
| D. | 常温下,水电离出的c(H+)=1×10-12mol/L的溶液中:NH4+、Na+、Cl-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com