
科目: 来源: 题型:选择题
| A. | pH=3的0.1mol•L-1的NaHC2O4溶液中:c(C2O42-)<c(H2C2O4) | |
| B. | 0.1mol•L-1的Na2S溶液中:2c(Na+)=c(S2-)+c(HS-)+c(H2S) | |
| C. | pH=4的CH3COOH溶液中:$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-10 | |
| D. | 等物质的量浓度、等体积的NaF溶液和HF溶液混合所得的稀溶液中:c(H+)+c(Na+)=c(F-)+c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
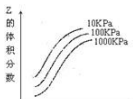
| A. | 上述可逆反应的正反应为放热反应 | |
| B. | X、Y、Z 均为气态 | |
| C. | X 和 Y 中只有一种是气态,Z 为气态 | |
| D. | 上述反应的正反应的△S<0 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.3mol | B. | 小于0.15mol | C. | 0.15~0.3mol | D. | 0.15mol |
查看答案和解析>>
科目: 来源: 题型:解答题
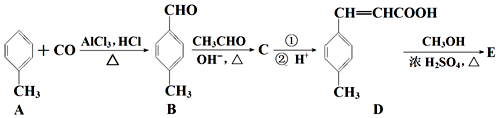
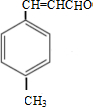 ;D→E的反应类型为酯化反应.
;D→E的反应类型为酯化反应.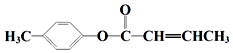 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为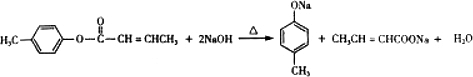 .
. .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原混合溶液中c(K+)为1 mol•L-1 | |
| B. | 上述电解过程中共转移4 mol电子 | |
| C. | 电解得到的Cu的物质的量为0.5 mol | |
| D. | 电解后溶液中c(H+)为2 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2P2(g)=P4(g)△H=-229.7 kJ•mol-1 | B. | P2制P4是放热反应 | ||
| C. | P2比P4更加稳定 | D. | 等质量时P2比P4具有的能量高 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 冰融化成水放出热量 | |
| B. | 化学键断裂过程一定放出能量 | |
| C. | 生成物的总能量一定低于反应物的总能量 | |
| D. | 化学键的断裂和形成是化学反应中能量变化的主要原因 |
查看答案和解析>>
科目: 来源: 题型:解答题
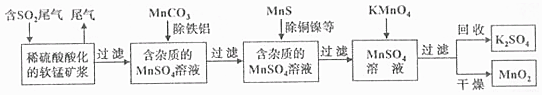
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com