
科目: 来源: 题型:选择题
| A. | 往0.3mol/L的NH3•H2O溶液中加入少量NaOH固体,NH3•H2O的电离平衡向逆反应方向移动,同时溶液中c(OH-)•c(NH4+)/c(NH3•H2O)将减小 | |
| B. | PH=9的NaOH溶液和NH3•H2O溶液中,由水电离出的c(H+)前者小于后者 | |
| C. | 浓度均为0.1mol/L的CH3COOH与CH3COONa溶液等体积混合后,PH=5,则混合溶液中:c(CH3COO-)-c(CH3COOH)=2×(10-5-10-9)mol/L | |
| D. | 相同条件下,将足量的氢氧化铁固体加入到相同体积的下列溶液:①蒸馏水②0.1mol/L氢氧化钠③0.1mol/L氢氧化钡④0.1mol/L氯化铁,则铁离子浓度:④>①>②═③ |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
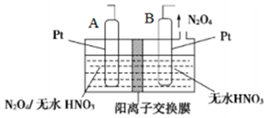 氮的氧化物种类较多,有N2O、NO、N2O3、NO2、N2O4、N2O5等,他们应用广泛.
氮的氧化物种类较多,有N2O、NO、N2O3、NO2、N2O4、N2O5等,他们应用广泛.查看答案和解析>>
科目: 来源: 题型:实验题
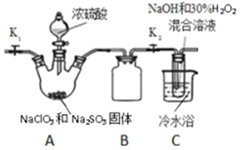 亚氯酸钠(NaClO2)和ClO2都是重要的漂白剂.通常情况下,ClO2是一种具有强氧化性的黄色气体,常用于水的净化和纸浆、纺织品的漂白.ClO2易发生爆炸,在生产、使用时可用其它气体进行稀释.ClO2易与碱反应生成亚氯酸盐和氯酸盐.
亚氯酸钠(NaClO2)和ClO2都是重要的漂白剂.通常情况下,ClO2是一种具有强氧化性的黄色气体,常用于水的净化和纸浆、纺织品的漂白.ClO2易发生爆炸,在生产、使用时可用其它气体进行稀释.ClO2易与碱反应生成亚氯酸盐和氯酸盐.查看答案和解析>>
科目: 来源: 题型:选择题
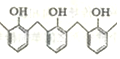 …的高聚物,其单体是甲醛和苯酚
…的高聚物,其单体是甲醛和苯酚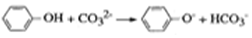
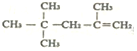 的名称为:2,4,4,-三甲基-1-戊烯
的名称为:2,4,4,-三甲基-1-戊烯| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol甲基中含有电子数为10NA | |
| B. | 常温下,1LpH=12的Na2CO3溶液中含有的OH-离子数为0.01 NA | |
| C. | 标准状况下,NO和O2各11.2L混合充分反应,所得气体的分子总数为0.75 NA | |
| D. | 50mL12mol•L-1盐酸和足量MnO2共热,转移的电子数为0.3 NA |
查看答案和解析>>
科目: 来源: 题型:解答题

| 离子种类 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目: 来源: 题型:解答题
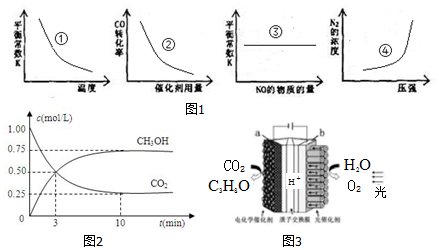
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向Fe2(SO4)3溶液中加入铁粉:Fe3++Fe═2Fe3+ | |
| B. | 石灰石溶于醋酸:CaCO3+2CH3COOH═2CH3COO-+Ca2++CO2↑+H2O | |
| C. | 铜跟浓硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+═H2SiO3↓+2Na+ |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com