
科目: 来源: 题型:解答题
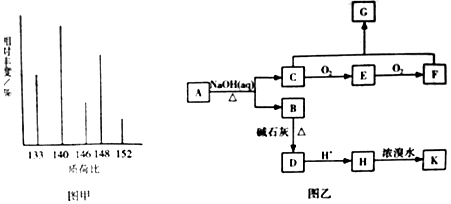
 、K
、K .
.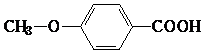 .(本题不考虑
.(本题不考虑 结构).
结构).查看答案和解析>>
科目: 来源: 题型:选择题
| 编号 | ① | ② | ③ |
| PH | 11 | 3 | 3 |
| 溶液 | NaOH溶液 | CH3COOH溶液 | HF溶液 |
| A. | CH3COOH稀溶液中加入少量CH3COONa,能使比值c(CH3COO-)/c(Na+)增大 | |
| B. | ①、②等体积很合后:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 向②加入NaF固体,CH3COOH电离平衡正向移动 | |
| D. | 中和相同体积的②、③,需消耗①的体积②<③ |
查看答案和解析>>
科目: 来源: 题型:实验题
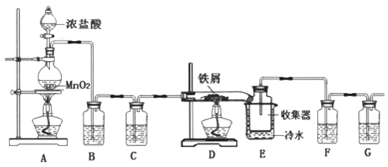
查看答案和解析>>
科目: 来源: 题型:选择题
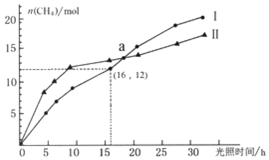 可利用如下反应将二氧化碳转化为甲烷:CO2(g)+2H2O(g)?CH4(g)+2O2(g)△H=+802KJ/mol,右图为在恒温、光照、不同初始浓度和不同催化剂(Ⅰ、Ⅱ)作用下,体积为2L的莫比容器中n(CH4)随光照时间的变化曲线.下列说法正确的是( )
可利用如下反应将二氧化碳转化为甲烷:CO2(g)+2H2O(g)?CH4(g)+2O2(g)△H=+802KJ/mol,右图为在恒温、光照、不同初始浓度和不同催化剂(Ⅰ、Ⅱ)作用下,体积为2L的莫比容器中n(CH4)随光照时间的变化曲线.下列说法正确的是( )| A. | 0-15h内,催化剂Ⅱ的催化效果比催化剂Ⅰ效果好 | |
| B. | 反应开始后的30h内,第Ⅰ种催化剂的作用下,反应吸收的热量多 | |
| C. | a点时,CO2的转化率相等 | |
| D. | 0-16h内,v(O2)=1.5mol/(L•h) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化学键的断裂与形成一定伴随着电子的转移和能量变化 | |
| B. | 碘晶体是分子晶体,加热升华过程中只需克服分子间作用力 | |
| C. | 二氧化硅晶体属于原子晶体,每个Si通过共价键与4个O结合 | |
| D. | 氯化钠的电离是一个破坏离子键的过程 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 实验 | c(CuCl2) | 实验现象 |
| I | 0.25mol/L | 有红色固体析出,有气泡冒出,一段时间内出气速率加快. |
| II | 2.00mol/L | 反应剧烈,有红色固体析出,产生大量气泡,有白色难溶物,试管外壁温度明显升高,一段时间内出气速率加快. |
查看答案和解析>>
科目: 来源: 题型:解答题
| 固体活性炭/mol | NO/mol | A/mol | B/mol | |
| 200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 |
| 335℃ | 2.005 | 0.0500 | 0.0250 | 0.0250 |
查看答案和解析>>
科目: 来源: 题型:解答题
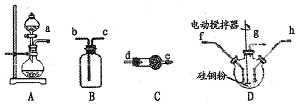
查看答案和解析>>
科目: 来源: 题型:解答题
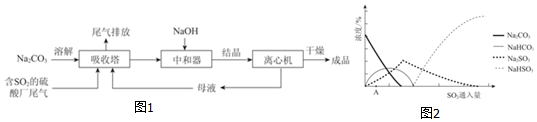
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com