
科目: 来源: 题型:选择题
| A. | 中子数为10的氧原子:810O | B. | 氧负离子(O2-)的结构示意图: | ||
| C. | Na2O2的电子式: | D. | 1-丙醇的结构简式: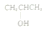 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 84消毒液的有效成分是NaClO | |
| B. | 装饰材料释放的甲醛会造成污染 | |
| C. | 高纯硅广泛应用于太阳能电池和计算机芯片 | |
| D. | 食品/保鲜膜、塑料水杯等生活用品的主要成分是聚氯乙烯 |
查看答案和解析>>
科目: 来源: 题型:解答题
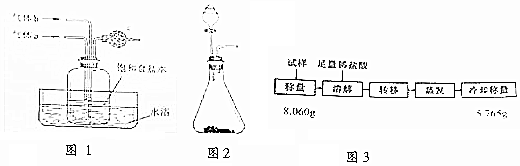
查看答案和解析>>
科目: 来源: 题型:解答题

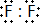 ,两者气态氢化物的稳定性是:HF>HCl(填写化学式).
,两者气态氢化物的稳定性是:HF>HCl(填写化学式).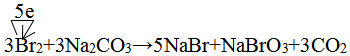 .
.查看答案和解析>>
科目: 来源: 题型:解答题
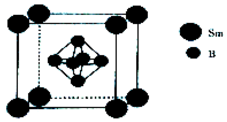 硼及其化合物在工农业生产中应用广泛.
硼及其化合物在工农业生产中应用广泛.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 18g重水(D2O)所含的电子数为10NA | |
| B. | 常温常压下,0.3mol NO2完全与水反应,转移的电子教为0.2NA | |
| C. | 标准状况下,22.4L CCl4中含有NA个CCl4分子 | |
| D. | 常温下,1L 0.1mol/L CH3COONa溶液中Na+离子数为0.1NA |
查看答案和解析>>
科目: 来源: 题型:实验题
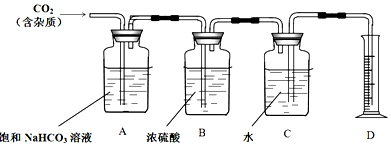
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com