
科目: 来源: 题型:选择题
| A. | 熟石膏的化学式:2CaSO4•H2O | B. | 明矾的化学式:KAlSO4•12H2O | ||
| C. | 氨分子的结构式: | D. | NH4H的电子式: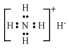 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 规定序号 | 待测体积/mL | 盛装标准滴定管的起点读数/mL | 盛装标准滴定管的终点读数/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
| 城市 | 北京 | 上海 | 天津 | 重庆 | 南京 | 厦门 | 珠海 | 汕头 | 济南 | 杭州 | 成都 |
| 污染指数 | 92 | 72 | 82 | 98 | 95 | 25 | 47 | 54 | 76 | 67 | 87 |
| 首要污染物 | TSP | NOx | TSP | SO2 | TSP | TSP | TSP | TSP | |||
| 空气级别 | Ⅱ | Ⅱ | Ⅱ | Ⅱ | Ⅱ | Ⅰ | Ⅰ | Ⅱ | Ⅱ | Ⅱ | Ⅱ |
查看答案和解析>>
科目: 来源: 题型:填空题
 .硫化氢是一种可燃性气体,实验室在制备硫化氢时,尾气点燃前必须要验纯,硫化氢燃烧时发出淡蓝色色火焰,请写出任意一个硫化氢燃烧的化学反应方程式2H2S+O2$\frac{\underline{\;点燃\;}}{\;}$2S+2H2O.实验室制取硫化氢,多余的气体通常用NaOH溶液来吸收.
.硫化氢是一种可燃性气体,实验室在制备硫化氢时,尾气点燃前必须要验纯,硫化氢燃烧时发出淡蓝色色火焰,请写出任意一个硫化氢燃烧的化学反应方程式2H2S+O2$\frac{\underline{\;点燃\;}}{\;}$2S+2H2O.实验室制取硫化氢,多余的气体通常用NaOH溶液来吸收.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:多选题
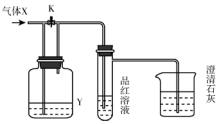 如图是一套检验气体性质的实验装置.向装置中缓缓通入气体X,若关闭活塞K,则品红溶液褪色.据此判断气体X和洗气瓶内的溶液Y可能的组合是( )
如图是一套检验气体性质的实验装置.向装置中缓缓通入气体X,若关闭活塞K,则品红溶液褪色.据此判断气体X和洗气瓶内的溶液Y可能的组合是( )| A | B | C | D | |
| X | 硫化氢 | 二氧化硫 | 二氧化碳 | 氯化氢 |
| Y | 浓硫酸 | 饱和NaHCO3 | Na2SO3溶液 | 饱和NaHSO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 浓硝酸与浓盐酸一样,在空气中出现白雾 | |
| B. | 硝酸见光分解和受热分解产物相同,都是NO2、O2、H2O | |
| C. | NO2和水反应有HNO3生成,所以NO2是硝酐 | |
| D. | 硝酸与金属反应,既表现出氧化性,又表现出酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com