
科目: 来源: 题型:实验题
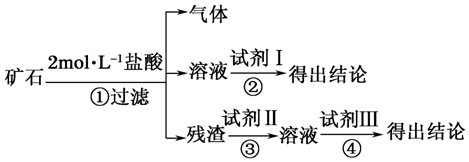
| 编号 | 实验操作 | 预期现象与结论 |
| ① | 取适量矿石研细,加足量2mol•L-1盐酸 | 有大量无色气体产生,得棕黄色溶液,且仍有少量固体残留 |
| ② | ||
| ③ | 取①操作残余固体适量置于烧杯,加入足量2mol•L-1NaOH溶液,充分搅拌 | 残余固体完全溶解于2mol•L-1NaOH溶液,并得无色溶液 |
| ④ |
查看答案和解析>>
科目: 来源: 题型:解答题
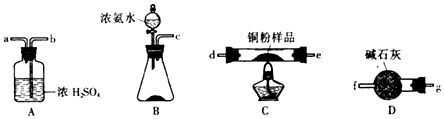
查看答案和解析>>
科目: 来源: 题型:填空题
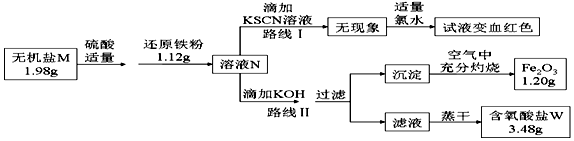
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2项 | B. | 3项 | C. | 4项 | D. | 5项 |
查看答案和解析>>
科目: 来源: 题型:解答题
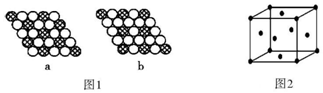 第四周期中的 18 种元素具有重要的用途.
第四周期中的 18 种元素具有重要的用途.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 均为0.84 L | B. | 均为0.56 L | C. | ①>② | D. | ①<② |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
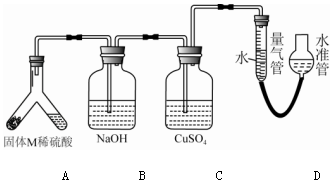
查看答案和解析>>
科目: 来源: 题型:解答题
 用ClO2处理后的自来水中,ClO2的浓度应在0.10~0.80mg/L之间.用碘量法检测水中C1O2浓度的实验步骤如下:
用ClO2处理后的自来水中,ClO2的浓度应在0.10~0.80mg/L之间.用碘量法检测水中C1O2浓度的实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com