
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
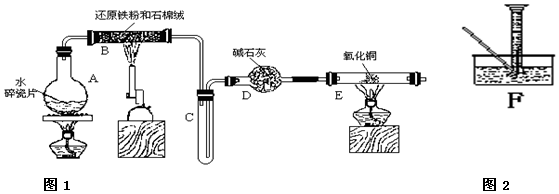
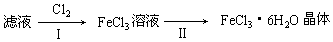
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 144.0gCuSO4 | B. | 144.0gCuSO4•5H2O | ||
| C. | 255.0gCuSO4•5H2O | D. | 250.0gCuSO4•5H2O |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1:2:3 | B. | 3:2:1 | C. | 6:3:2 | D. | 2:3:6 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目: 来源: 题型:选择题
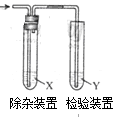 用图所示装置检验乙烯时不需要除杂的是( )
用图所示装置检验乙烯时不需要除杂的是( )| 乙烯 的制备 | 试剂X | 剂Y | |
| A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
| C | CH3CH2OH与浓硫酸加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | CH3CH2OH与浓硫酸加热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| B. | Fe2O3$\stackrel{盐酸}{→}$FeCl2$\stackrel{Cu}{→}$Fe | |
| C. | FeS2$\stackrel{O_{2}/高温}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| D. | NH3$→_{催化剂}^{O_{2},△}$NO$\stackrel{H_{2}O}{→}$HNO3 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com