
科目: 来源: 题型:实验题
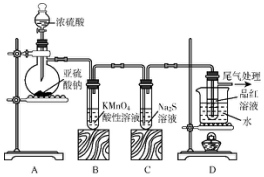
查看答案和解析>>
科目: 来源: 题型:填空题
 ,空间构型三角锥形
,空间构型三角锥形查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 只产生BaSO4沉淀 | B. | 只产生BaSO3沉淀 | ||
| C. | 一定有BaSO4和BaSO3沉淀 | D. | 一定有SO2、SO3气体逸出 |
查看答案和解析>>
科目: 来源: 题型:选择题
 如图装置实验,一段时间后某同学记录如下:
如图装置实验,一段时间后某同学记录如下:| A. | ③④⑤ | B. | ③④ | C. | ①②③ | D. | ②④⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 二氧化硫气体能用浓硫酸干燥,是因为二氧化硫无还原性 | |
| B. | 医疗上可用硫酸钡X射线透视肠胃的内服药,是因为硫酸钡不溶于酸 | |
| C. | 将某气体通入品红溶液中,品红溶液褪色,该气体一定是二氧化硫 | |
| D. | 浓H2SO4可以用铝制容器贮存,说明常温下铝与浓H2SO4不反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
 氧化锌、硫化锌都是重要的基础化工原料.
氧化锌、硫化锌都是重要的基础化工原料.查看答案和解析>>
科目: 来源: 题型:推断题
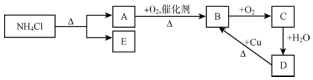
查看答案和解析>>
科目: 来源: 题型:填空题
 ,1-18号元素中,与氮的最外层电子数相等的元素原子结构示意图是
,1-18号元素中,与氮的最外层电子数相等的元素原子结构示意图是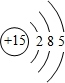 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{(a+c)}{(a+b)}$ | B. | $\frac{(a+2c)}{(a+b+c)}$ | C. | $\frac{2(a+c)}{(a+2b+c)}$ | D. | $\frac{(a+2c)}{(a+2b)}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com