
科目: 来源: 题型:选择题
| A. | 标准状态下,22.4LSO3含有原子数为4NA | |
| B. | 4℃时,18gH2O含有2NA 个非极性键 | |
| C. | 1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| D. | 将含1molFeCl3的饱和溶液滴入沸水形成的胶体粒子的数目为NA |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 第一步需选用仪器①、②和⑨,仪器①的名称叫坩埚 | |
| B. | 第二步用浓硝酸溶解茶叶灰,可能将Fe2+氧化成Fe3+ | |
| C. | 要完成第三步,需选用④、⑤和⑦,除夹持仪器外还缺滤纸 | |
| D. | 第四步,用试剂⑧检验滤液中的Fe3+,溶液中生成血红色沉淀 |
查看答案和解析>>
科目: 来源: 题型:选择题
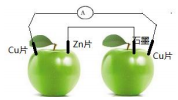 如图所示,在两个绿苹果中插入Cu片、Zn片和石墨棒,然后用导线连接,电流计指针偏转,则下列说法正确的是( )
如图所示,在两个绿苹果中插入Cu片、Zn片和石墨棒,然后用导线连接,电流计指针偏转,则下列说法正确的是( )| A. | 该装置为两个原电池串联 | B. | Zn片为电源负极 | ||
| C. | 两个Cu片均不参加反应 | D. | 石墨上有O2生成 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化学反应的能量变化只表现为反应放热或吸热两种形式 | |
| B. | 一个反应的反应物总能量大于生成物总能量,则该反应的焓变一定小于零 | |
| C. | 燃烧热的大小与热化学方程式中可燃物计量系数成正比 | |
| D. | 含1mol硫酸的稀溶液与足量NaOH稀溶液反应生成水所放出的热量为中和热 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ${\;}_{8}^{18}$O2-离子结构示意图: | B. | HClO的结构式:H-O-Cl | ||
| C. | NF3的比例模型: | D. | H2O2的电子式: |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 复分解反应 | B. | 化合反应 | C. | 离子反应 | D. | 氧化还原反应 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4项 | B. | 5项 | C. | 6项 | D. | 7 项 |
查看答案和解析>>
科目: 来源: 题型:实验题

| 实验步骤 | 预期的现象和结论 |
| ①测定B中实验所用混合溶液的 ②配制具有相同pH的稀硝酸与 BaCl2的混合液并通入适当的N2 ③将SO2通入上述溶液中 | 若出现白色沉淀则假设2成立 若不出现白色沉淀则假设2不成立 |
查看答案和解析>>
科目: 来源: 题型:解答题
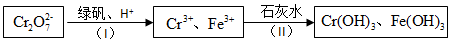
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com