
科目: 来源: 题型:选择题

| A. | 用饱和食盐水和稀硫酸为原料制取HCl | |
| B. | 用大理石和稀硫酸制取CO2 | |
| C. | 用铁和盐酸为原料制取H2 | |
| D. | 用双氧水和二氧化锰为原料制取O2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在H2SO4溶液中滴入Ba(OH)2溶液至溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ | |
| D. | 醋酸溶解鸡蛋壳:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
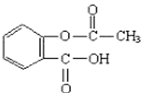
| A. | 该物质能与浓溴水发生取代反应 | B. | 该物质能发生酯化反应 | ||
| C. | 该物质属于蛋白质 | D. | 该物质极易溶于水和有机溶剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
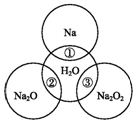 如图两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
如图两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )| A. | 反应③最多能产生0.1 mol O2 | |
| B. | 反应①的离子方程式为Na+2H2O═Na++2OH-+H2↑ | |
| C. | Na2O2中阴阳离子数目之比为1:1 | |
| D. | ①②③充分反应后所得溶液中溶质的质量分数:②=③>① |
查看答案和解析>>
科目: 来源: 题型:解答题
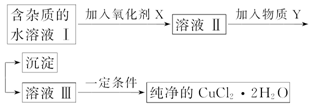
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 离子半径:W>Y>Z | |
| B. | Z的单质不能与水反应 | |
| C. | 简单氢化物的沸点:W>Y | |
| D. | 最高价氧化物对应的水化物的酸性:X>W |
查看答案和解析>>
科目: 来源: 题型:解答题
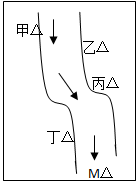 在一条鱼虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示,箭头表示河水流向),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色混浊,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.
在一条鱼虾绝迹的小河边有四座工厂:甲、乙、丙、丁(如图所示,箭头表示河水流向),它们排出的废液里,每个工厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水检测时发现:①甲处河水呈乳白色,②乙处河水呈红褐色混浊,③丙处河水由浑变清,④丁处产生气泡,河水仍清,⑤M处水样的pH小于7.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Mg2+向正极迁移 | |
| B. | 正极反应为:Mo3S4+2xe-═Mo3S${\;}_{4}^{2{x}^{-}}$ | |
| C. | Mo3S4发生氧化反应 | |
| D. | 负极反应为:xMg-2xe-═xMg2+ |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1.0mol/L的KNO3溶液:Na+、Fe2+、Cl-、SO42- | |
| B. | 含有NaOH的溶液:K+、Ba2+、HCO3-、Cl- | |
| C. | 能与Al反应生成H2的溶液:NH4+、K+、NO3-、Cl- | |
| D. | 饱和氯水中:K+、Na+、Cl-、HSO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com