
科目: 来源: 题型:实验题
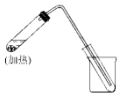 如图是用自来水制取少量蒸馏水的简易装置(加热及固定仪器略),其原理与教材中的实验完全相同.回答下列问题:
如图是用自来水制取少量蒸馏水的简易装置(加热及固定仪器略),其原理与教材中的实验完全相同.回答下列问题:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在粗盐提纯中,当加热到蒸发皿中有较多固体析出,残留少量液体时,停止加热,用余热将液体蒸干 | |
| B. | 当振荡分液漏斗中的混合溶液时,须用一只手压住分液漏斗的玻璃塞,另一只手握住旋塞,将分液漏斗倒转过来,用力振荡 | |
| C. | 粗盐提纯得到精盐的过程一定需要两次过滤操作 | |
| D. | 实验过程中若皮肤不慎沾上少量碱液,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯化氢的摩尔质量为36.5g | |
| B. | 1mol H2SO4 的质量为98 g.mol-1 | |
| C. | 任何物质的摩尔质量都等于他的相对分子质量或相对原子质量 | |
| D. | CO2 的摩尔质量是H2 的摩尔质量的22倍 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 摩尔是国际七个基本物理量之一 | |
| B. | 含NA个O原子的O2物质的量为0.5mol | |
| C. | 6.02×1023个任何物质的量均为1mol | |
| D. | 1mol氢含有6.02×1023个氢 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
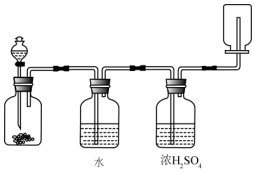
| A. | 锌和盐酸生成氢气 | B. | 氯酸钾和二氧化锰生成氧气 | ||
| C. | 碳酸钙和盐酸生成二氧化碳 | D. | 氯化钠和浓硫酸生成氯化氢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com