
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaHCO3在水溶液中的电离方程式为NaHCO3=Na++H++CO32- | |
| B. | NaHCO3溶液与NaOH溶液反应的离子方程式为H++OH-=H2O | |
| C. | NH4NO3溶液与NaOH稀溶液反应的离子方程式为NH4++OH-=NH3•H2O | |
| D. | NH4NO3溶液与足量Ba(OH)2溶液反应的离子方程式为Ba2++CO32-=BaCO3↓ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 漂白粉、漂粉精可用于饮用水及餐具等的消毒 | |
| B. | 福尔马林可用于食品的消毒,如浸泡海鲜,使其不易变质 | |
| C. | 药用酒精可用于食物及饮用水消毒 | |
| D. | 过氧乙酸无须稀释可直接使用消毒,不会对人体造成伤害 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含1molFeCl3溶液水解生成1molFe(OH)3胶体后生成NA个胶体粒子 | |
| B. | 分子数为NA的N2,CO混合气体体积为22.4L,质量为28g | |
| C. | 0.5molFeBr2与足量氯气反应转移的电子数为NA | |
| D. | 足量Zn与一定量的浓硫酸反应,产生22.4L标准状况气体时,转移的电子数为2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化合物:干冰,明矾,烧碱 | B. | 同素异形体:C60,石墨,金刚石 | ||
| C. | 非电解质:乙醇,四氯化碳,氯气 | D. | 混合物:纯净矿泉水,盐酸,漂白粉 |
查看答案和解析>>
科目: 来源: 题型:选择题
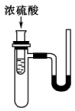 如图小试管中盛有几毫升水,与大试管连通的U形管内放有少量水(已染成红色).如沿小试管壁慢慢注入3mL浓硫酸,静置后,U形管中可观察到的现象是液面( )
如图小试管中盛有几毫升水,与大试管连通的U形管内放有少量水(已染成红色).如沿小试管壁慢慢注入3mL浓硫酸,静置后,U形管中可观察到的现象是液面( )| A. | 左高右低 | B. | 左低右高 | C. | 左右一样高 | D. | 来回振动 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 已知2C(s)+O2(g)=2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热为-110.5 kJ•mol-1 | |
| B. | 在101kPa下氢气的燃烧热△H=-285.8 kJ•mol-1,则水分解的热化学方程式:2 H2O (l)=2H2 (g)+O2 (g)△H=+285.8 kJ•mol-1 | |
| C. | Ba(OH)2(aq)+H2SO4(aq)=BaSO4(s)+2H2O(l)△H=-2akJ•mol-1,则任何强酸和强碱发生中和反应生成1molH2O(l)的反应热均为-akJ•mol-1 | |
| D. | 1g甲烷完全燃烧生成液态水的过程中放出55.6kJ热量,则CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com