
科目: 来源: 题型:选择题
| A. | 不同元素的原子结构的分子只含极性共价键 | |
| B. | 137Cs和133Cs是中子数不同质子数相同的同种核素 | |
| C. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| D. | 同周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
查看答案和解析>>
科目: 来源: 题型:多选题
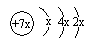 ,b与c形成的化合物的电子式为
,b与c形成的化合物的电子式为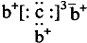 ,下列比较中正确的是( )
,下列比较中正确的是( )| A. | 原子半径:a>b>c | B. | 非金属性:a>c | ||
| C. | 氢化物的稳定性:c>a | D. | 最高价含氧酸的酸性:c>a |
查看答案和解析>>
科目: 来源: 题型:实验题
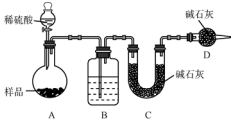 某校课外小组为测定某Na2CO3和NaHCO3混合物中Na2CO3的质量分数,甲、乙两组同学分别进行了下列相关实验.
某校课外小组为测定某Na2CO3和NaHCO3混合物中Na2CO3的质量分数,甲、乙两组同学分别进行了下列相关实验.查看答案和解析>>
科目: 来源: 题型:实验题
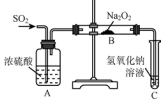 (1)已知Na2O2能与CO2反应,可用来呼吸面具中的做生氧剂.该反应:
(1)已知Na2O2能与CO2反应,可用来呼吸面具中的做生氧剂.该反应:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 2:3 |
查看答案和解析>>
科目: 来源: 题型:实验题
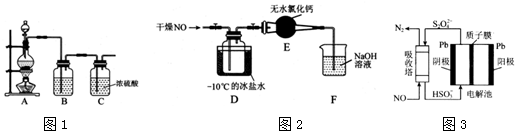
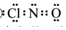
查看答案和解析>>
科目: 来源: 题型:实验题

| 实验操作及现象 | ④向2mL0.2mol/L FeCl3溶液中滴入2mL1mol/LNaF溶液.溶液变无色 |
| ⑤向2mL0.2mol/L FeCl3溶液中滴入2mL蒸馏水,溶液颜色变浅 |
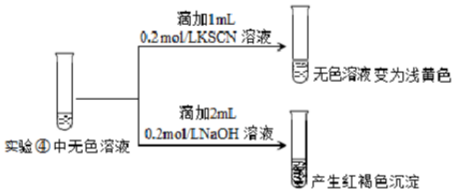
查看答案和解析>>
科目: 来源: 题型:实验题
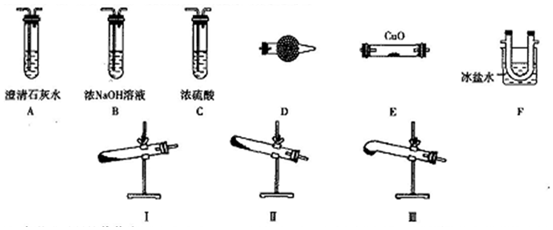
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com