
科目: 来源: 题型:选择题
| A. | X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应 | |
| B. | 原子半径大小关系:X>Y,Z<W | |
| C. | 化合物Z2Y和ZWY都只存在离子键 | |
| D. | Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂 |
查看答案和解析>>
科目: 来源:2016-2017学年四川省成都市高一上10月月考化学试卷(解析版) 题型:选择题
A实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室
B在气体发生装置上直接点燃一氧化碳气体时,必须要先检验一氧化碳气体的纯度.最简单的方法是用排空气的方法先收集一试管气体,点燃气体,听爆鸣声
C 制氧气时排水法收集氧气后出现倒吸现象,应立即松开试管上的橡皮塞
D凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,在$\frac{c(H+)}{c(OH-)}$=1012的溶液中,Fe2+、I-、NO3-、Cl-一定不能大量共存 | |
| B. | H2A是二元弱酸,常温下,0.1mol/LNaHA溶液的pH约为5,说明HA-电离程度大于水解程度 | |
| C. | 使用催化剂一定能够降低化学反应的反应热(△H) | |
| D. | NA为阿伏加德罗常数的值,常温常压下,28gC2H4和C3H6混合气体含有的原子数为6NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Ge(32号元素)的单晶可以作为光电转换材料用于太阳能电池 | |
| B. | 交警检查司机是否酒后驾车的原理中体现了乙醇的还原性 | |
| C. | 在家用电热水器不锈钢内胆镶嵌镁棒,以防止内胆被腐蚀 | |
| D. | 施用适量石灰乳可降低盐碱地(含较多NaCl、Na2CO3)的碱性 |
查看答案和解析>>
科目: 来源: 题型:解答题
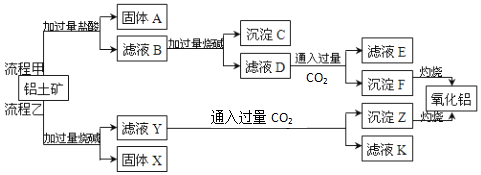
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用新制的Cu(OH)2悬浊液检验淀粉是否水解完全 | |
| B. | 先滴加KSCN溶液无明显现象,再滴加H2O2溶液,检验溶液中是否含Fe2+ | |
| C. | 加热氯化铵固体制取适量氨气 | |
| D. | 用饱和碳酸氢钠溶液除去Cl2中含有的HCl |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | “朱”的主要成分是Hg2S | B. | 该反应为置换反应 | ||
| C. | 该反应不符合质量守恒定律 | D. | 该反应Hg作还原剂 |
查看答案和解析>>
科目: 来源: 题型:解答题
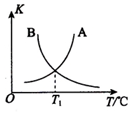 乙苯(
乙苯( )在有机合成中占有重要的地位,有着广泛的用途.
)在有机合成中占有重要的地位,有着广泛的用途.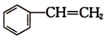 (g)+HCl(g)?
(g)+HCl(g)? (g)△H1=-54kJ•mol-1
(g)△H1=-54kJ•mol-1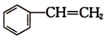 (g)+H2(g)?
(g)+H2(g)? (g)△H2=-121kJ•mol-1
(g)△H2=-121kJ•mol-1| 化学键 | C-H | C-C | C=C | C-Cl | H-Cl |
| 键能/(kJ•mol-1) | 412 | 348 | X | 341 | 432 |
 (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(g)△H4
(g)+HCl(g)△H4 (g)、2mol Cl2(g)、1mol
(g)、2mol Cl2(g)、1mol  (g)、2mol HCl(g),则开始时,v正=(填“>”、“<”或“=”)v逆.
(g)、2mol HCl(g),则开始时,v正=(填“>”、“<”或“=”)v逆.查看答案和解析>>
科目: 来源: 题型:选择题
 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mL a mol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mL a mol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )| A. | A点溶液中加少量水,$\frac{c({H}^{+})}{c(N{{H}_{4}}^{+})}$减小 | |
| B. | 原氨水的物质的量浓度约为1.006×10-2mol•L-1 | |
| C. | A、B、C三点溶液中水电离出来的c(OH-):A>B>C | |
| D. | C点时,盐酸和氨水恰好完全反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com