
科目: 来源: 题型:解答题
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
查看答案和解析>>
科目: 来源: 题型:选择题
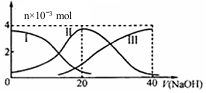 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中I代表H2A,II代表HAˉ,III代表A2ˉ).根据图判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中I代表H2A,II代表HAˉ,III代表A2ˉ).根据图判断,下列说法正确的是( )| A. | 当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(A2-)>c(H+)>c(HA-)>c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大 | |
| C. | 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+3c(H2A)+c(HA-)=c(A2-)+2c(OH-) | |
| D. | 向NaHA溶液加入水的过程中,pH可能增大也可能减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
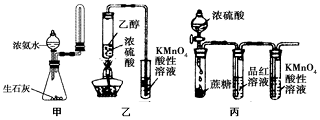
| A. | 实验室用图甲所示装置制取少量氨气 | |
| B. | 为使100ml0.5mol/L的NaNO3溶液物质的量浓度变为1mol/L,可将原溶液加热蒸发掉50ml水 | |
| C. | 利用图乙装置,可制取乙烯并验证其易被酸性KMnO4溶液氧化 | |
| D. | 利用图丙装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 物质 | 苯甲酸 | 乙醇 | 环己烷 | 浓硫酸 | 苯甲酸乙酯 |
| 沸点/℃ | 249 | 78.3 | 80.7 | 338 | 212.6 |
 +CH3CH2OH$?_{60℃}^{浓H_{2}SO_{4}}$
+CH3CH2OH$?_{60℃}^{浓H_{2}SO_{4}}$ +H2O;实验装置中冷凝管的主要作用是冷凝回流.
+H2O;实验装置中冷凝管的主要作用是冷凝回流.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 证明浓度的改变可导致平衡移动:将少量KCl晶体加入FeCl3+3KSC?Fe(SCN)3+3KCl的平衡体系中 | |
| B. | 除去MgCl2溶液中少量的FeCl3:向含有少量FeCl3的MgCl2溶液中加入足量的Mg(OH)2粉末,搅拌一段时间后过滤 | |
| C. | 检验某溶液中是否含有乙醛:向盛有2mL 10%CuSO4溶液的试管中滴加0.5mL10%NaOH溶液,混合均匀,滴入待检液,加热 | |
| D. | 证明Fe3+的氧化性大于I2:将KI溶液和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置,下层溶液显紫红色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液中:Na+、Fe2+、MnO4-、AlO2- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-12mol/L,的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | PH=0的溶液中:Al3+、Ag(NH3)2+、I-、SO42- | |
| D. | 加入Mg能放出H2的溶液中:Ca2+、NH4+、ClO-、NO3- |
查看答案和解析>>
科目: 来源: 题型:多选题
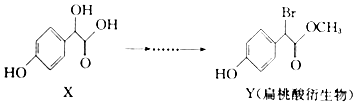
| A. | 化合物X的分子式为C8H8O4 | |
| B. | 化合物X、Y均可与NaHCO3溶液反应生成CO2 | |
| C. | 化合物X、Y分子中均含有1个手性碳原子 | |
| D. | 在一定条件下,化合物Y可发生加成反应和消去反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
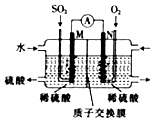 某兴趣小组用电化学法模拟工业处理SO2.强硫酸工业尾气中的SO2通入如图装置(电极均为惰性材料)进行实验.下列说法正确的是( )
某兴趣小组用电化学法模拟工业处理SO2.强硫酸工业尾气中的SO2通入如图装置(电极均为惰性材料)进行实验.下列说法正确的是( )| A. | N极为负极 | |
| B. | 反应一段时间后,左侧电解质溶液的pH增大 | |
| C. | M极发生的电极反应为SO2+2H2O-2e-═SO42-+4H+ | |
| D. | 在相同条件下,M、N两极上消耗的气体体积之比为1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com