
科目: 来源: 题型:选择题
| A. | ${\;}_{117}^{293}$Up和${\;}_{117}^{294}$Up属于同种核素 | |
| B. | ${\;}_{117}^{293}$Up和${\;}_{117}^{294}$Up互为同位素 | |
| C. | ${\;}_{117}^{293}$Up和${\;}_{117}^{294}$Up的中子数不同,化学性质不同 | |
| D. | ${\;}_{117}^{293}$Up和${\;}_{117}^{294}$Up的质量数不同、电子数也不同 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
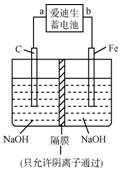 铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题:
铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铜片、铁片、FeCl3溶液组成的原电池 | |
| B. | 石墨、铁片、FeCl3溶液组成的原电池 | |
| C. | 镁片、锌片、Fe2(SO4)3溶液组成的原电池 | |
| D. | 银片、铁片、Fe(NO3)3溶液组成的原电池 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入2mL0.1mol•L-1盐酸 | B. | 加入2mL0.1mol•L-1氢氧化钡溶液 | ||
| C. | 加入2mL0.1mol•L-1硫酸铜溶液 | D. | 加入2mL0.1mol•L-1氨水 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原电池的负极发生还原反应 | |
| B. | 电化学反应的实质是金属单质失去电子形成阳离子,而电子直接给氧化剂 | |
| C. | 金属在潮湿环境中主要发生析氢腐蚀 | |
| D. | 铜铁在潮湿的中性环境中锈蚀时,开始有Fe(OH)2,而后逐渐变成Fe(OH)3和Fe2O3 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 次氯酸的电子式: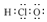 | B. | S2-的结构示意图: | ||
| C. | O-18的原子符号:${\;}_{\;}^{15}$O | D. | CO2分子的结构式:O=C=O |
查看答案和解析>>
科目: 来源: 题型:解答题
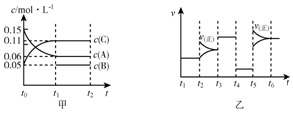 向某密闭容器中加入0.15mol/A、0.05mol/LC和一量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图中甲图所示[t0时c(B)未画出,t1时增大到0.05mol/L].乙图中t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况.
向某密闭容器中加入0.15mol/A、0.05mol/LC和一量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图中甲图所示[t0时c(B)未画出,t1时增大到0.05mol/L].乙图中t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况.| T1~t2 | T3~t4 | T4~t5 | T6~t |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
科目: 来源: 题型:选择题
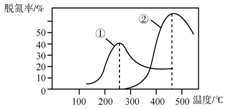 工业上采用NH3作还原剂脱氮原理为:NO(g)+NO2(g)+2NH3(g)?2N2(g)+3HO(g),烟气以一定的流速通过,测量不同温度下逸出气体中氮氧化物含量,从而确定烟气效率,右图是两种不同催化剂的脱氮效率曲线,判断以下分析不正确的是( )
工业上采用NH3作还原剂脱氮原理为:NO(g)+NO2(g)+2NH3(g)?2N2(g)+3HO(g),烟气以一定的流速通过,测量不同温度下逸出气体中氮氧化物含量,从而确定烟气效率,右图是两种不同催化剂的脱氮效率曲线,判断以下分析不正确的是( )| A. | 上述反应的正反应为放热反应 | |
| B. | 催化剂①、②分别适合于250℃和450℃左右脱氮 | |
| C. | 曲线①、②最高点表示此时平衡转化率最高 | |
| D. | 相同条件下,改变压强对脱氮率没有影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com