
科目: 来源: 题型:选择题
| A. | 用容量瓶配制溶液时,先用蒸馏水洗涤,再用待装溶液润洗 | |
| B. | 用湿润的红色石蕊试纸检验酸性气体 | |
| C. | 用烧杯加热分解Al(OH)3固体 | |
| D. | 用分液漏斗分离乙酸乙酯和饱和碳酸钠溶液 |
查看答案和解析>>
科目: 来源: 题型:实验题
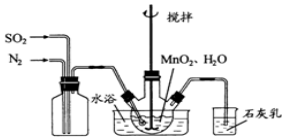
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
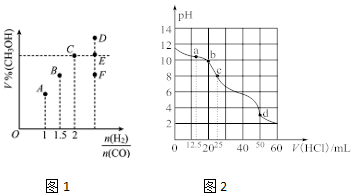
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 体积分数为75%的酒精溶液会使细菌蛋白质变性 | |
| B. | 1 mol甲烷和1 mol氯气在光照条件下充分反应,生成的CH3Cl少于1 mol | |
| C. | 除去乙酸乙酯中少量的乙酸:用饱和氢氧化钠溶液洗涤,并分液、干燥、蒸馏 | |
| D. | 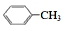 的一溴代物和 的一溴代物和 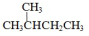 的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH值都为4的稀盐酸和NH4Cl溶液中,水的电离程度相同 | |
| B. | 浓度均为0.1mol/L的醋酸和NaOH溶液等体积混合后:lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$]=0 | |
| C. | 在含浓度都为0.01mol/L的Cl-、CrO42-的混合溶液中滴加AgNO3溶液,先出现沉淀的是AgCl.[已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12] | |
| D. | 浓度均为0.1mol/L的NH4Cl和CH3COONH4溶液中,c(NH4+)相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 元素非金属性由弱到强的顺序为Z<Y<X | |
| B. | 化合物YZ2中各原子都达到8电子结构 | |
| C. | 这3种元素的氢化物的沸点由高到低的顺序为:Z>Y>X | |
| D. | 其对应的阴离子半径由大到小的顺序为:Z>Y>X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com