
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 10 | B. | 12 | C. | 24 | D. | 28 |
查看答案和解析>>
科目: 来源: 题型:解答题
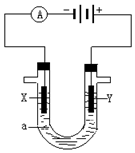 人们习惯上把电解饱和食盐水的工业叫做氯碱工业.
人们习惯上把电解饱和食盐水的工业叫做氯碱工业.查看答案和解析>>
科目: 来源: 题型:选择题
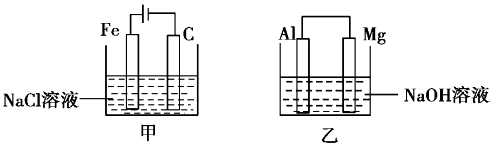
| A. | 甲装置中有沉淀生成,乙装置中Mg电极上有气泡生成 | |
| B. | 反应后,甲装置中溶液的质量增大,乙装置中溶液的质量减小 | |
| C. | 电极反应式:甲中阳极Fe-2e-=Fe2+,乙中负极Mg-2e-=Mg2+ | |
| D. | 反应后甲中溶液的pH减小,乙中溶液的pH增大 |
查看答案和解析>>
科目: 来源: 题型:填空题
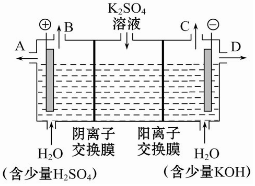 如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾.
如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾.查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电解饱和食盐水制氯气时,用铜片作阳极 | |
| B. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| C. | 在原电池中,电子流出的一极是负极,发生氧化反应 | |
| D. | 在铁制品上镀银时,铁制品与电源正极相连 |
查看答案和解析>>
科目: 来源: 题型:解答题
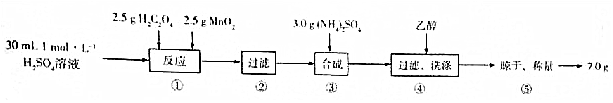
查看答案和解析>>
科目: 来源: 题型:解答题
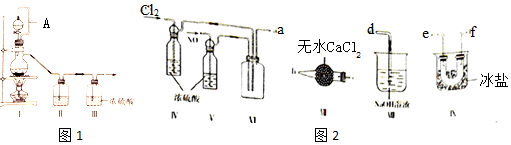
| 装置Ⅰ | 装置Ⅱ | ||
| 烧瓶中 | 分液漏斗中 | ||
| 制备纯净Cl2 | MnO2 | ① | ② |
| 制备纯净NO | Cu | ③ | ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com