
科目: 来源: 题型:实验题
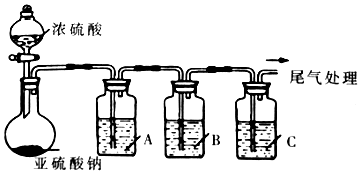
| 试剂 | 作用 | |
| A | 验证SO2的还原性 | |
| B | Na2S溶液 | |
| C | 品红溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
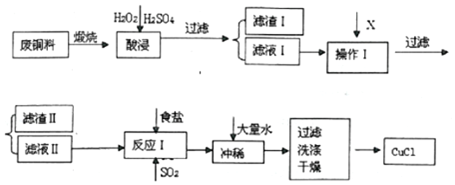
| 物质 | 开始沉淀pH | 沉淀完全pH |
| Fe(OH)3 | 2.2 | 3.2 |
| Cu(OH)2 | 5.6 | 6.7 |
| Al(OH)3 | 3.7 | 4.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(mL) | 0.75 | 0.50 | 0.80 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.75 | 24.85 | 24.80 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
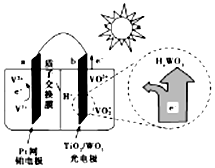
| A. | 光照时,b极的电极反应式为VO2+-e-+H2O═VO2++2H+ | |
| B. | 光照时,毎转移2mol电子,有2mol H+由a极区经质子交换膜向b极区迁移 | |
| C. | 夜间,a极的电极反应式为V3++e-═V2+ | |
| D. | 硅太阳能电池供电原理与该电池相同 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
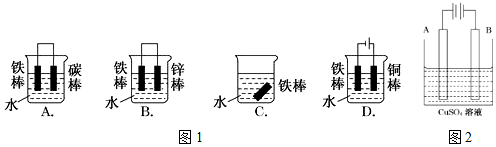
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电解饱和食盐水时阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 粗铜精炼时,与电源正极相连的是铜 | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 锌为负极,二氧化锰为正极 | |
| B. | 锌为正极,二氧化锰为负极 | |
| C. | 工作时电子由二氧化锰经外电路流向锌极 | |
| D. | 锌电极发生还原反应,二氧化锰发生氧化反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-═BaSO4↓ | |
| D. | 氧化镁与稀硫酸混合:MgO+2H+═Mg2++H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com