
科目: 来源: 题型:选择题
| 编号 | 实验操作 | 实验现象 | 解释与结论 |
| A | 将SO2气体通入KMnO4(H+)溶液中 | 溶液褪色 | SO2有漂白性 |
| B | 将SO2气体通入H2S溶液中 | 溶液变浑浊 | SO2有氧化性 |
| C | 将SO2气体通入紫色石蕊溶液中 | 溶液先变红色后褪色 | SO2是酸性氧化物 |
| D | 将SO2气体通入Ca(ClO)2溶液中 | 溶液变浑浊 | 亚硫酸的酸性比次氯酸的酸性强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 工业上利用铝热反应炼铁 | |
| B. | 将Mg、Al用导线连接并插入NaOH溶液中,判断Mg、Al金属性强弱 | |
| C. | 将CO2、SO2分别通入Ba(NO3)2溶液中,前者无明显现象,后者产生白色沉淀 | |
| D. | 实验室利用锌片和稀硫酸制H2时,为了加快制H2的反应速率可加入Cu(NO3)2 |
查看答案和解析>>
科目: 来源: 题型:解答题
 (R为烃基),其中一种辣椒素酯类化合物J的合成路线如图:
(R为烃基),其中一种辣椒素酯类化合物J的合成路线如图: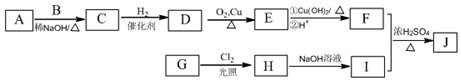
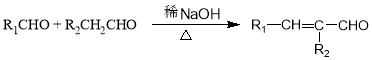
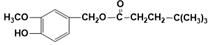 .
.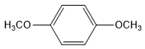 (写结构简式).
(写结构简式).查看答案和解析>>
科目: 来源: 题型:解答题
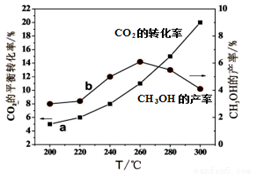 甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:| 温度(℃) | 500 | T |
| CO2的平衡转化率 | 60% | 40% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2,2-二甲基丙烷也称新戊烷 | |
| B. | 由乙烯生成乙醇属于加成反应 | |
| C. | 分子式为C5H11Cl的有机物共有8种(不含立体异构) | |
| D. | 所有的糖类、油脂、蛋白质都可以发生水解反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | Cl2通入NaOH溶液中:Cl2+OH-═Cl-+ClO-+H2O | |
| C. | 二氧化氮与水反应:3NO2+H2O═2H++2NO3-+NO | |
| D. | 往碳酸镁中滴加稀盐酸:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电池放电时,电池负极周围溶液的pH不断增大 | |
| B. | 电池放电时,镍元素被氧化 | |
| C. | 电池充电时,氢元素被氧化 | |
| D. | 电池放电时,H2是负极 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 35Cl原子所含质子数为18 | |
| B. | $\frac{1}{18}$mol的1H35Cl的分子所含中子数约为6.02×1023 | |
| C. | 3.5Cl2气体的体积约为22.4L | |
| D. | 35Cl2气体的摩尔质量为70 |
查看答案和解析>>
科目: 来源: 题型:解答题
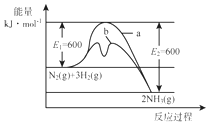 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.| 编号 | 温度/K | 反应时间/h | 反应物质的量配比 | 实验目的 |
| ① | 573 | 4 | 1:3 | 实验②和④探究温度对产率的影响 |
| ② | 573 | 4 | 1:4 | |
| ③ | 573 | 3 | 4:1 | 实验②和③探究反应时间对 产率的影响 |
| ④ | 673 | 4 | 1:4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 升高温度可增大单位体积活化分子数百分数,促进有效碰撞,从而提高反应速率 | |
| B. | 增大体系压强可增大单位体积活化分子数,促进有效碰撞,从而提高反应速率 | |
| C. | 放热反应(△H<0)和熵增(△S>0)反应一定能自发反应 | |
| D. | 由能量守恒可知任何放热反应都可设计成原电池 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com