
科目: 来源: 题型:选择题
| A. | 0.1 mol | B. | 0.2 mol | C. | 0.3 mol | D. | 0.4 mol |
查看答案和解析>>
科目: 来源: 题型:解答题
| 测定序号 | NaHCO3溶液的体积/mL | 盐酸标准液滴定管中的读数/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 1.50 | 21.52 |
| 2 | 20.00 | 1.80 | 25.62 |
| 3 | 20.00 | 0.20 | 20.18 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 正极发生还原反应 2O2+4H2O+8e-═8OH- | |
| B. | 通入CH4的电极为负极 | |
| C. | 该电池使用一段时间后应补充KOH | |
| D. | 燃料电池工作时,溶液中的OH-向正极移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
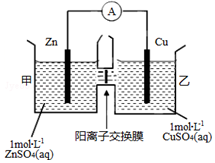 锌铜原电池装置如图所示,中间被阳离子交换膜隔开且只允许阳离子和水分子通过,下列有关叙述正确的是( )
锌铜原电池装置如图所示,中间被阳离子交换膜隔开且只允许阳离子和水分子通过,下列有关叙述正确的是( )| A. | 铜电极上发生氧化反应 | |
| B. | 外电路中电子由Cu流向Zn | |
| C. | 电池工作一段时间后,乙池溶液的总质量增加 | |
| D. | 电池工作一段时间后,甲池的C(SO42-)增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe2+、NO3-、K+、Cl- | B. | K+、Al3+、HCO3-、Cl- | ||
| C. | H+、Ca2+、HCO3-、Cl- | D. | Ca2+、HCO3-、OH-、NO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | -48.5kJ/mol | B. | +48.5kJ/mol | C. | -45.5kJ/mol | D. | +45.5kJ/mol |
查看答案和解析>>
科目: 来源: 题型:选择题
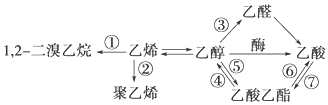
| A. | 反应①是加成反应 | B. | 只有反应②是加聚反应 | ||
| C. | 只有反应⑦是取代反应 | D. | 反应③是氧化反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
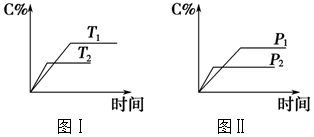
| A. | 化学方程式中m+n<e+f | |
| B. | 达平衡后,若升温,平衡左移 | |
| C. | 达平衡后,加入催化剂则C%增大 | |
| D. | 达平衡后,增加A的量有利于平衡向右移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,0.1 mol•L-1 NH4Cl溶液的pH=1 | |
| B. | 工业上电解饱和食盐水时,以石墨为阴极,铁棒为阳极 | |
| C. | 反应CO2(g)+C(s)═2CO(g)在高温下可自发进行,则该反应的△H>0 | |
| D. | 常温下,在AgCl悬浊液中加入少量NaCl饱和溶液,[Ag+]减小,Ksp(AgCl)减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com