
科目: 来源: 题型:选择题
| A. | 糖类是人体能量的主要来源 | |
| B. | 食盐可作调味剂,也可作食品防腐剂 | |
| C. | 天然存在的动植物油脂,大多属于单甘油酯 | |
| D. | 乙烯可作水果催熟剂,能促进水果尽早成熟 |
查看答案和解析>>
科目: 来源: 题型:解答题
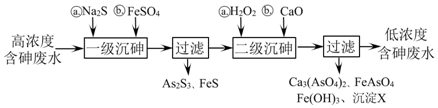
 ;②步骤2的离子方程式为12Ag++2H3As+3H2O═12Ag↓+As2O3+12H+;
;②步骤2的离子方程式为12Ag++2H3As+3H2O═12Ag↓+As2O3+12H+;查看答案和解析>>
科目: 来源: 题型:实验题
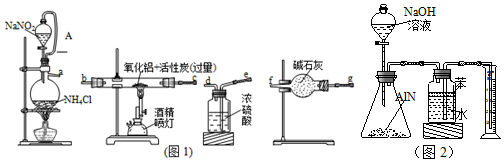
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 9 g超重水(3H216O)含中子数为6NA | |
| B. | 标准状况下,22.4 L CCl4含有的分子数目为NA | |
| C. | 常温常压下,16g甲烷中共价键数目为4NA | |
| D. | 1 L 0.1 mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1 NA |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 9 g38903Sr2+中含有的电子数为3.6 NA | |
| B. | 某温度下纯水的pH=6,该温度下1L pH=11的NaOH溶液中含OH-的数目为0.1NA | |
| C. | 一定温度下,1 L 0.5 mol•L-1 NH4Cl溶液与2 L 0.25 mol•L-1NH4Cl溶液含NH4+均为0.5NA | |
| D. | 丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若A为非金属单质,则D一定为硝酸或硫酸 | |
| B. | 若A为金属单质,则A一定位于第三周期、IA族 | |
| C. | 不论A为单质还是化合物,D都有可能是同一种物质,该物质的浓溶液在常温下都能使铁和铝发生钝化 | |
| D. | 若A是共价化合物,A的水溶液一定能显碱性 |
查看答案和解析>>
科目: 来源: 题型:选择题
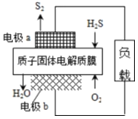 科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫.质子膜H2S燃料电池的结构示意图如图所示.下列说法不正确的是( )
科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫.质子膜H2S燃料电池的结构示意图如图所示.下列说法不正确的是( )| A. | 电极a为电池的负极 | |
| B. | 电极b上发生的电极反应为:O2+4H++4e-═2H2O | |
| C. | 电路中每流过4 mol电子,在正极消耗44.8LH2S | |
| D. | 每17 g H2S参与反应,有1 mol H+经质子膜进入正极区 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子式为C5H10O2且能与Na2CO3溶液反应产生气体的有机物的同分异构体有4种 | |
| B. | 用酸性高锰酸钾溶液既可以鉴别甲烷和乙烯,也可以除去甲烷中的乙烯 | |
| C. | 乙烷和氯气制氯乙烷和乙烯与氯化氢反应制氯乙烷反应类型不同 | |
| D. | 用碳酸钠溶液可一次性鉴别乙酸、苯和乙醇三种无色液体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验装置 | 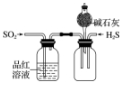 | 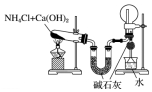 | 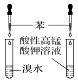 | 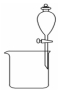 |
| 实验设计 | 探究SO2的氧化性和漂白性 | 实验室制氨气并收集干燥的氨气 | 验证苯中是否有碳碳双键 | 用乙醇提取溴水中的Br2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | “绿色化学”的核心是应用化学原理对环境污染进行治理 | |
| B. | “火树银花”中的焰火实质上是金属元素的焰色反应 | |
| C. | 李白有诗云“日照香炉生紫烟”这是描写“碘的升华” | |
| D. | 煤经过气化、液化和干馏等物理变化过程,可以转化为清洁能源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com