
科目: 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 向某食盐溶液中滴加淀粉溶液,溶液颜色没有变为蓝色 | 不是加碘食盐 |
| B | 某溶液中加入硝酸酸化的Ba(NO3)2溶液,无现象,再滴加AgNO3溶液,有白色沉淀生成 | 溶液中一定含有Cl- |
| C | 室温下,用pH试纸分别测0.100mol•L-1 CH3COONa溶液和0.100mol•L-1 Na2S溶液的pH,后者pH大 | 酸性:H2S<CH3COOH |
| D | 将气体X分别通入溴水和酸性高锰酸钾溶液,两溶液均褪色 | 气体X一定是C2H4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
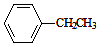 $→_{加热}^{Fe_{2}O_{3}}$
$→_{加热}^{Fe_{2}O_{3}}$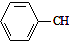 =CH2+H2,下列说法正确的是( )
=CH2+H2,下列说法正确的是( )| A. | 酸性高锰酸钾溶液和溴水都可以用来鉴别乙苯和苯乙烯 | |
| B. | 乙苯、苯乙烯均能发生取代反应、加聚反应,氧化反应 | |
| C. | 乙苯的一氯取代产物有共有5种 | |
| D. | 乙苯和苯乙烯分子内共平面的碳原子数最多均为7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1.8gH2O与CH2D2的混合物中所含质子数为NA | |
| B. | 1mol甲烷或白磷(P4)分子中所含共价键数均为4NA | |
| C. | 1mol CH3COOC2H5在稀硫酸溶液中水解可得到乙醇分子数为NA | |
| D. | 25℃时,l L pH=1的H2SO4溶液中含有的H+ 数为0.2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 油脂和蛋白质是人体必需的营养物质,都属于高分子化合物 | |
| B. | 食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是防止食品氧化变质 | |
| C. | 城际“轻轨电车”启动时,电车电刷与导线的接触点会产生高温,石墨可用作接触点上的材料 | |
| D. | 中医古籍《肘后备急方》中“青蒿一握,以水二升渍,绞取汁,尽服之”启发了屠呦呦,采用低温提取,解决了关键性的技术难题.青蒿素的提取属于化学变化 |
查看答案和解析>>
科目: 来源: 题型:解答题
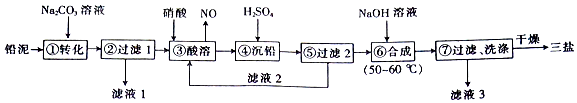
| 化合物 | PbSO4 | PbCO3 |
| 溶解度/g | 1.03×10-4 | 1.81×10-7 |
| Ksp | 1.82×10-8 | 1.46×10-13 |
查看答案和解析>>
科目: 来源: 题型:实验题
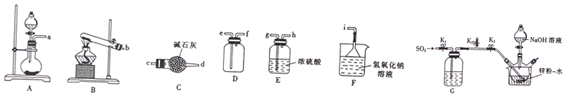
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 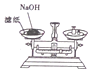 称取一定量的NaOH | |
| B. | 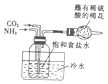 制取NaHCO3 | |
| C. | 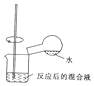 检验浓硫酸与铜反应后的产物中是否含有铜离子 | |
| D. | 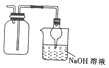 收集NO2丙防止其污染环境 |
查看答案和解析>>
科目: 来源: 题型:选择题
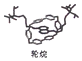 法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,合成轮烷的基本原料有CH2C12、丙烯、戊醇、苯,下列说法不正确的是( )
法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,合成轮烷的基本原料有CH2C12、丙烯、戊醇、苯,下列说法不正确的是( )| A. | CH2C12有两种同分异构体 | |
| B. | 丙烯能使溴水褪色 | |
| C. | 戊醇在一定条件下能与乙酸发生酯化反应 | |
| D. | 苯与足量氢气在镍催化作用下会发生加成反应生成环己烷 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | lmo1CH4中含有的电子数为9NA | |
| B. | 0.1mol•L-1的Na2S溶液中所含阴离子的数目大于0.1NA | |
| C. | 1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为2NA | |
| D. | 80℃时,1LNaCl溶液中含有OH-的数目为1×10-7NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 性质 | 实际应用 |
| A | 蛋白质受热变性 | 用高温加热的方法杀死流感病毒 |
| B | 明矾溶液显酸性 | 用明矾溶液清除铜镜表面的铜锈 |
| C | Na2CO3溶液显碱性 | 用热的纯碱溶液洗去油污 |
| D | P2O5具有吸水性 | 用P2O5干燥氨气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com