
科目: 来源: 题型:选择题
| A. | NaCl晶体 BaSO4 | B. | 铜 二氧化硫 | ||
| C. | 液态的醋酸 酒精 | D. | 熔融的KNO3 硫酸溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
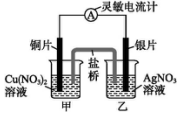
| A. | 将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同 | |
| B. | 铜导线替换盐桥,原电池仍继续工作 | |
| C. | 开始时,银片上发生的反应是Ag-e-═Ag+ | |
| D. | 电子通过盐桥从乙池流向甲池 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 油脂均为固体 | |
| B. | 油脂在体内直接氧化产生热量 | |
| C. | 多吃动物脂肪比多吃植物油有利 | |
| D. | 有些脂肪酸是人体必需的,但在人体内却不能合成;脂肪中必需脂肪酸的含量越高,其营养价值越高 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 两次平衡时,C(g)的浓度相等 | |
| B. | 平衡时,单位时间内n(B)生成:n(C)消耗=1:1 | |
| C. | 若再向平衡体系中加入少量A,平衡不移动 | |
| D. | 若开始时向容器中加入1 mol B和1 mol C,则达到平衡时吸收QkJ热量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | x+y<z | ||
| C. | B的转化率升 | D. | C的体积分数下降 |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:实验题


| 操 作 | 现 象 |
| 取0.1mol/L的FeBr2溶液100mL,测溶液的pH | pH试纸变红(约为4) |
 | ⅰ.开始通入100mLCl2(折合标准状况),溶液由浅绿色逐渐变黄; ⅱ.稍后,继续通入Cl2,溶液黄色加深,变为棕黄色; iii.稍后,溶液由棕黄色变浅,最终变为黄色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 生铁比软铁芯(几乎是纯铁)容易生锈 | |
| B. | 银质奖牌久置后表面变暗 | |
| C. | 铁质器件附有铜质配件,在接触处易生铁锈 | |
| D. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com