
科目: 来源: 题型:选择题
| A. | 加热胆矾失去结晶水,得到白色无水硫酸铜,这一过程叫风化 | |
| B. | 家用石碱(主要成分是Na2CO3•10H2O )久置后,由块状变成粉末状,这一变化是风化的结果 | |
| C. | 含有水蒸气的气体通过固体NaOH 时,固体表面出现水珠,这是固体氢氧化钠潮解的原故 | |
| D. | 从冰箱取出物品,表面很快出现水珠,这种现象叫潮解 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 红热的铜丝在硫蒸汽中燃烧,产生黑色固体 | |
| B. | 碘水中加入少量CCl4,振荡静置后,下层颜色变浅,上层颜色变为紫色 | |
| C. | 往溴水中加入碘化钠溶液,溴水变为无色 | |
| D. | 氢气在Cl2中燃烧产生白色的烟 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 发生水合过程,并且放出热量 | |
| B. | 发生扩散过程,并且放出热量 | |
| C. | 水合过程放出的热量大于扩散过程吸收的热量 | |
| D. | 扩散过程放出的热量大于水合过程吸收的热量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{r({F}^{-})}{r(M{g}^{2+})}$ | B. | $\frac{r(N{a}^{+})}{r(M{g}^{2+})}$ | C. | $\frac{r(Cl)}{r(C{l}^{-})}$ | D. | $\frac{r(Na)}{r(N{a}^{+})}$ |
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使甲基橙呈红色的溶液中:K+、Ba2+、OH-、AlO2- | |
| B. | 由水电离出C(H+)=1×10-14溶液中:Ca2+、K+、Cl-、HCO3- | |
| C. | $\frac{C({H}^{+})}{C(O{H}^{-})}$=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | C(Fe3+)=0.1mol/L的溶液中:K+、CO32-、SO42-、SCN- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaAlO2溶液中通入过量的CO2:2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32- | |
| B. | 新制氯水中:Cl2+H2O?2H++ClO-+Cl- | |
| C. | 200 mL 2 mol/L的FeBr2溶液中通入11.2L标准状况下的氯气:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl- | |
| D. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数(25℃) | Ka=1.77 ×10-4 | Ka=4.0 ×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
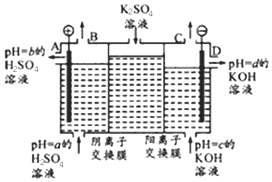
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com