
科目: 来源: 题型:选择题
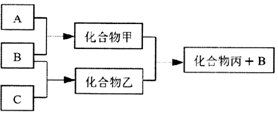 如图所示转化关系中A、B、C均为双原子气态单质,分别由短周期主族元素X、Y、Z组成.其中单质B含共用电子对数最多,甲和丙分子中均含有10个电子.下列说法错误的是( )
如图所示转化关系中A、B、C均为双原子气态单质,分别由短周期主族元素X、Y、Z组成.其中单质B含共用电子对数最多,甲和丙分子中均含有10个电子.下列说法错误的是( )| A. | Z元素位于第二周期第VIA族 | |
| B. | 可用排水法收集化合物乙 | |
| C. | 元素X、Y、Z的原子半径大小关系为X<Z<Y | |
| D. | 化合物甲溶于化合物丙中,存在的微粒有5种 |
查看答案和解析>>
科目: 来源: 题型:解答题
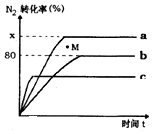 氢气是一种高能燃料,也广范应用在工业合成中.
氢气是一种高能燃料,也广范应用在工业合成中.查看答案和解析>>
科目: 来源: 题型:实验题
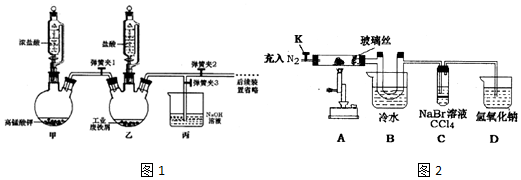
| 操作步骤 | 实验现象 | 解释原因 |
| 打开K,充入氮气 | D中有气泡产生 | ①充入N2的原因排出装置内的空气 |
| 关闭K,加热至600℃,充分灼烧固体 | B中出现棕黄色固体 | ②产生现象的原因FeC13易升华 |
| 实验结束,振荡C静置 | ③溶液分层,上层接近无色,下层橙红色 | ④2FeC13$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl2+Cl2,2Br-+Cl2=Br2+2Cl-(用相关的方程式说明) |
| ⑤结合以上实验和文献资料,该固体可以确定的成分有FeC13、Fe2O3. | ||
查看答案和解析>>
科目: 来源: 题型:解答题
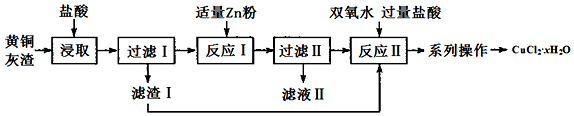
查看答案和解析>>
科目: 来源: 题型:选择题
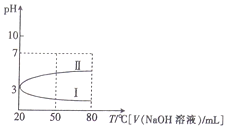
| A. | 0.1mol•L-1NH4Al(SO4)2溶液c(NH4+)大于等浓度的NH4HSO4溶液中c(NH4+) | |
| B. | 向100mL0.1mol•L-1NH4Al(SO4)2溶液中逐滴滴加80mL0.05 mol•L-1NaOH 溶液时,溶液pH的变化如曲线II | |
| C. | 升高温度,NH4Al(SO4)2溶液的pH减小,是因为促进了NH4Al(SO4)2的电离 | |
| D. | 20℃时,0.1mol•L-1NH4Al(SO4)2溶液中:2c(SO42-)-c(NH4+)-3c(Al3+)=10-3mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:实验题
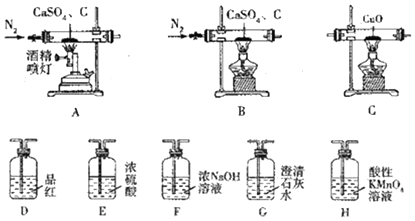
| 实验前 | 实验后 | |
| 实验1 | 装置C硬质玻璃管连同CuO质量为26.80g | 装置C硬质玻璃管连同反应后固体质量为26.64g |
| 实验2 | 装置G连同溶液质量为187.50g | 装置G连同反应后溶液及沉淀的质量为188.38g |
| 实验3 | 装置D、H连同溶液质量和为373.60g | 装置D、H连同溶液质量和为374.24g |
查看答案和解析>>
科目: 来源: 题型:选择题
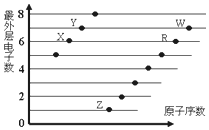
| A. | X与W形成的化合物中只有共价键 | B. | X与Z形成的化合物中只有离子键 | ||
| C. | 元素的非金属性:X>R>W | D. | 简单离子的半径:W>R>X |
查看答案和解析>>
科目: 来源: 题型:实验题
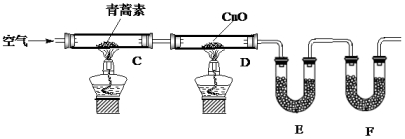
| 装置 | 实验前 | 实验后 |
| E | 24.00g | 33.90g |
| F | 100.00g | 133.00g |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )| A. | 该反应进行到M点放出的热量大于进行到W点放出的热量 | |
| B. | T2下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$ mol•L-1•min-1 | |
| C. | M点的正反应速率v正大于N点的逆反应速率v逆 | |
| D. | M点的正反应速率小于W点的逆反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com