
科目: 来源: 题型:解答题
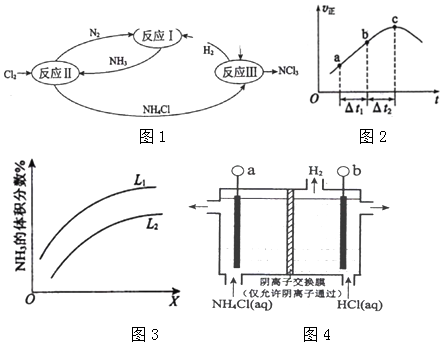
查看答案和解析>>
科目: 来源: 题型:填空题
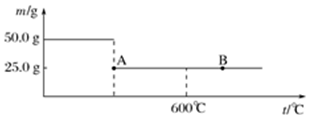
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:解答题
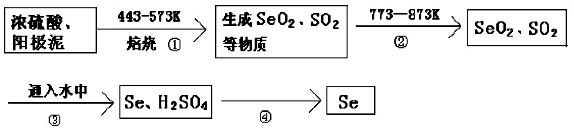
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 物质的量浓度相等的盐酸和氨水等体积混合,所得溶液的pH<7 | |
| B. | 物质的量浓度相等的硫酸和氨水等体积混合,所得溶液的pH<7 | |
| C. | pH=3的盐酸和pH=11的氨水等体积混合,所得溶液的pH>7 | |
| D. | pH=3的硫酸和pH=11的氨水等体积混合,所得溶液的pH<7 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶液浓度相等 | |
| B. | c(Cl-)=c(CH3COO-) | |
| C. | 等体积的两种酸,中和所需NaOH溶液的体积盐酸比醋酸多 | |
| D. | 分别加水稀释至原体积的10倍,盐酸的pH小于醋酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1-丁醇的结构简式可写作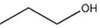 | |
| B. | 氨基酸合成多肽链属于加聚反应 | |
| C. | 分子式为C4H8O2,既含有羟基又含有醛基的同分异构体有5种 | |
| D. | 糖、油脂、蛋白质等这些人体必需的营养物质都是高分子化合物 |
查看答案和解析>>
科目: 来源: 题型:实验题
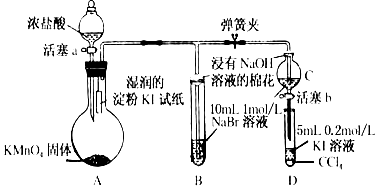
查看答案和解析>>
科目: 来源: 题型:实验题
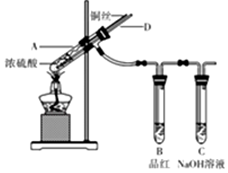 某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验,实验装置如图所示:
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验,实验装置如图所示:查看答案和解析>>
科目: 来源: 题型:实验题
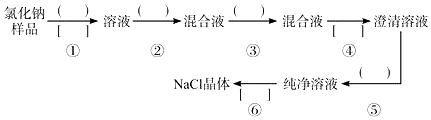
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com