
科目: 来源: 题型:选择题
| A. | 为防止食品的氧化变质,常在食品包装袋中放入生石灰 | |
| B. | 节日里绚丽的烟花,是通过某些金属元素的化学变化实现的 | |
| C. | SO2具有漂白性,通常用于银耳等食品的漂白 | |
| D. | 干冰或碘化银可用于进行人工降雨 |
查看答案和解析>>
科目: 来源: 题型:实验题
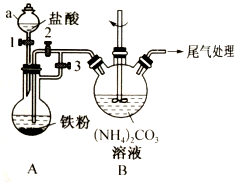 乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.以下是一种制备乳酸亚铁的实验方法.
乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.以下是一种制备乳酸亚铁的实验方法.查看答案和解析>>
科目: 来源: 题型:选择题
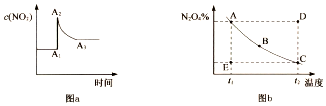
| A. | 其它条件不变时,向平衡体系中充入N2O4,平衡常数增大 | |
| B. | 图a中,A1一A2变化的原因一定是充人了NO2 | |
| C. | 图b中,E点对应状态中,v(正)>v(逆) | |
| D. | 图b中,E→A所需时间为x,D→C所需时间为y,则x<y |
查看答案和解析>>
科目: 来源: 题型:选择题
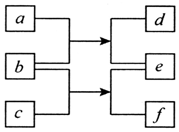 短周期元素W、X、Y、Z的原子序数依次增加,由上述元素组成的各物质转化关系如图所示.其中b为单质,其水溶液显酸性且具有漂白性;d为单质且具有同素异形体;常温下0.0l mol•L-1f溶液的pH<2.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加,由上述元素组成的各物质转化关系如图所示.其中b为单质,其水溶液显酸性且具有漂白性;d为单质且具有同素异形体;常温下0.0l mol•L-1f溶液的pH<2.下列说法正确的是( )| A. | 原子半径的大小W<Y<Z | B. | 元素的非金属性Z>X>Y | ||
| C. | Y的氧化物一定为酸性氧化物 | D. | Z的含氧酸一定为强酸 |
查看答案和解析>>
科目: 来源: 题型:解答题
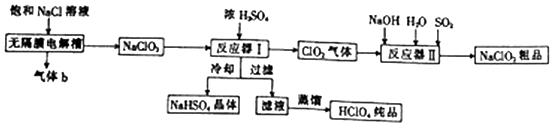
查看答案和解析>>
科目: 来源: 题型:解答题
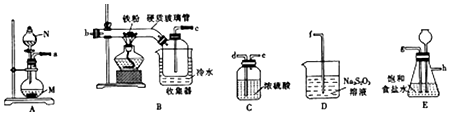
| 实验 | 操作 | 现象 | |
| 实验I(取褪色后溶液3等份) | 第1份 | 滴加FeCl3溶液 | 无明显变化 |
| 第2份 | 滴加KSCN溶液 | 溶液出现红色 | |
| 第3份 | 滴加稀盐酸和BaCl2 | 产生白色沉淀 | |
| 实验Ⅱ(取褪色后溶液同浓度的FeCi3溶液) | 滴加2KSCN溶液,溶液变红,再通入O2 | 无明显变化 | |
查看答案和解析>>
科目: 来源: 题型:解答题
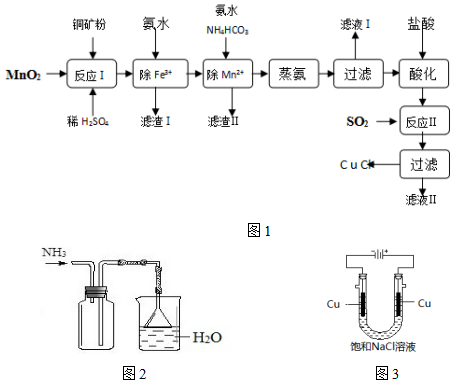
| 序号 | 温度/℃ | 时间/min | 压强/KPa | 残液颜色 |
| a | 110 | 60 | 101.3 | 浅蓝色 |
| b | 100 | 40 | 74.6 | 几乎很浅 |
| c | 90 | 30 | 60.0 | 无色透明 |
查看答案和解析>>
科目: 来源: 题型:解答题
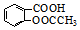 和
和 

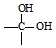 $\stackrel{自动脱水}{→}$
$\stackrel{自动脱水}{→}$
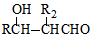 $\stackrel{△}{→}$
$\stackrel{△}{→}$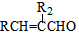 +H2O
+H2O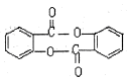 .
. .
.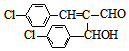 .
.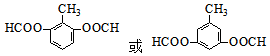 .(任写出一种)
.(任写出一种)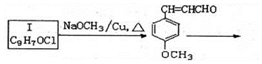
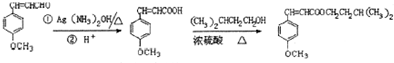 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应①中氧化剂与还原剂的物质的量之比为5:1 | |
| B. | 反应②中FeCl3只作氧化剂,反应③中FeCl3只是氧化产物 | |
| C. | 反应②中每生成127g I2,转移的电子数为2NA | |
| D. | 根据上述三个反应可知氧化性:ClO3->Cl2>Fe3+>I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com