
科目: 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 除去蛋白质中混有的(NH4)2SO4 | 将混合物装入半透明袋,并放入流动的蒸馏水中 |
| B | 除去Mg粉中混有Al粉 | 加入足量NaOH溶液,过滤、洗涤、干燥 |
| C | 用苯萃取溴水中的Br2 | 先从分液漏斗下口放出水层,再从上口倒出有机层 |
| D | 测定NaClO溶液中的pH | 用玻璃棒蘸取溶液点滴在pH试纸上,与标准比色卡对照 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
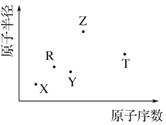 短周期主族元素 X、Y、Z、R、T 的原子半径与原子序数关系如图 所示.R 原子最外层电子数是电子层数的 2 倍,Y 与 Z 能形成 Z2Y、Z2Y2型离子化合物,Z 与 T 形成的化合物 Z2T 能破坏水的电离平衡.下列推断正确的是( )
短周期主族元素 X、Y、Z、R、T 的原子半径与原子序数关系如图 所示.R 原子最外层电子数是电子层数的 2 倍,Y 与 Z 能形成 Z2Y、Z2Y2型离子化合物,Z 与 T 形成的化合物 Z2T 能破坏水的电离平衡.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 最高价氧化物对应水化物的酸性:T<R | |
| C. | 氢化物的沸点不一定是:Y>R | |
| D. | 由 X、R、Y、Z 四种元素组成的化合物水溶液一定显碱性 |
查看答案和解析>>
科目: 来源: 题型:解答题
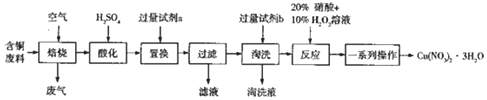
查看答案和解析>>
科目: 来源: 题型:实验题
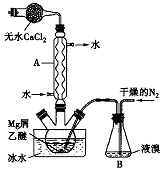 无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图所示(夹持仪器略去).主要步骤如下:
无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图所示(夹持仪器略去).主要步骤如下:查看答案和解析>>
科目: 来源: 题型:实验题
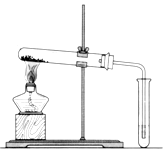 碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.
碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 胶体区别于其它分散系的本质特征是分散质的微粒直径在1nm~100nm | |
| B. | Fe(OH)3胶体带正电 | |
| C. | 往Fe(OH)3胶体中逐滴滴入硫酸溶液,现象是:先有红褐色沉淀后沉淀溶解 | |
| D. | Fe(OH)3胶体能够吸附水中悬浮的固体颗粒沉降,达到净水目的 |
查看答案和解析>>
科目: 来源: 题型:选择题
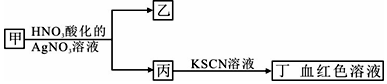
| A. | 若乙为白色沉淀,则甲中可能含有SiO32- | |
| B. | 若乙为淡黄色沉淀,则甲中可能含有FeBr3 | |
| C. | 若乙为淡黄色沉淀,则甲中可能含有S2- | |
| D. | 若乙为白色沉淀,则甲中一定含有FeCl3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 阳离子 | Al3+、Ba2+ |
| 阴离子 | OHˉ、SO42ˉ、Clˉ |
| A. | 往甲和乙的混合溶液中加入过量的丁溶液一定会生成白色沉淀 | |
| B. | 丙和丁的水溶液混合后会生成白色沉淀 | |
| C. | 一定温度下,丙溶于水会使水的电离程度增大 | |
| D. | 一定温度下,甲溶于水会使水的电离程度减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X、Y、Z均属于短周期元素 | |
| B. | 离子半径X+>Y- | |
| C. | X、Y、Z三种元素只能形成化合物XYZ3 | |
| D. | Y的气态氢化物的热稳定性可能较强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com